Natriumsulfat
Autoren: Hans-Jürgen Schwarz , Michael Steiger, Tim Müller, Amelie Stahlbuhk
zurück zu Sulfate
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
Abstract[Bearbeiten]
Die verschiedenen Phasen des Natriumsulfats sollen vorgestellt werden, sowie das Verhalten beispielsweise bezüglich Löslichkeit und Hygroskopizität.
Phasen und Hydratformen[Bearbeiten]
Bei den vier Phasen des Natriumsulfats sind lediglich zwei stabil. Die weiteren beiden Phasen sind metastabil, wurden aber ebenfalls beobachtet.
Thenardit Na2SO4
Natriumsulfat Phase III Na2SO4 metastabil
Natriumsulfat-Heptahydrat Na2SO4•7H2O metastabil
Mirabilit Na2SO4•10H2O
Löslichkeit[Bearbeiten]
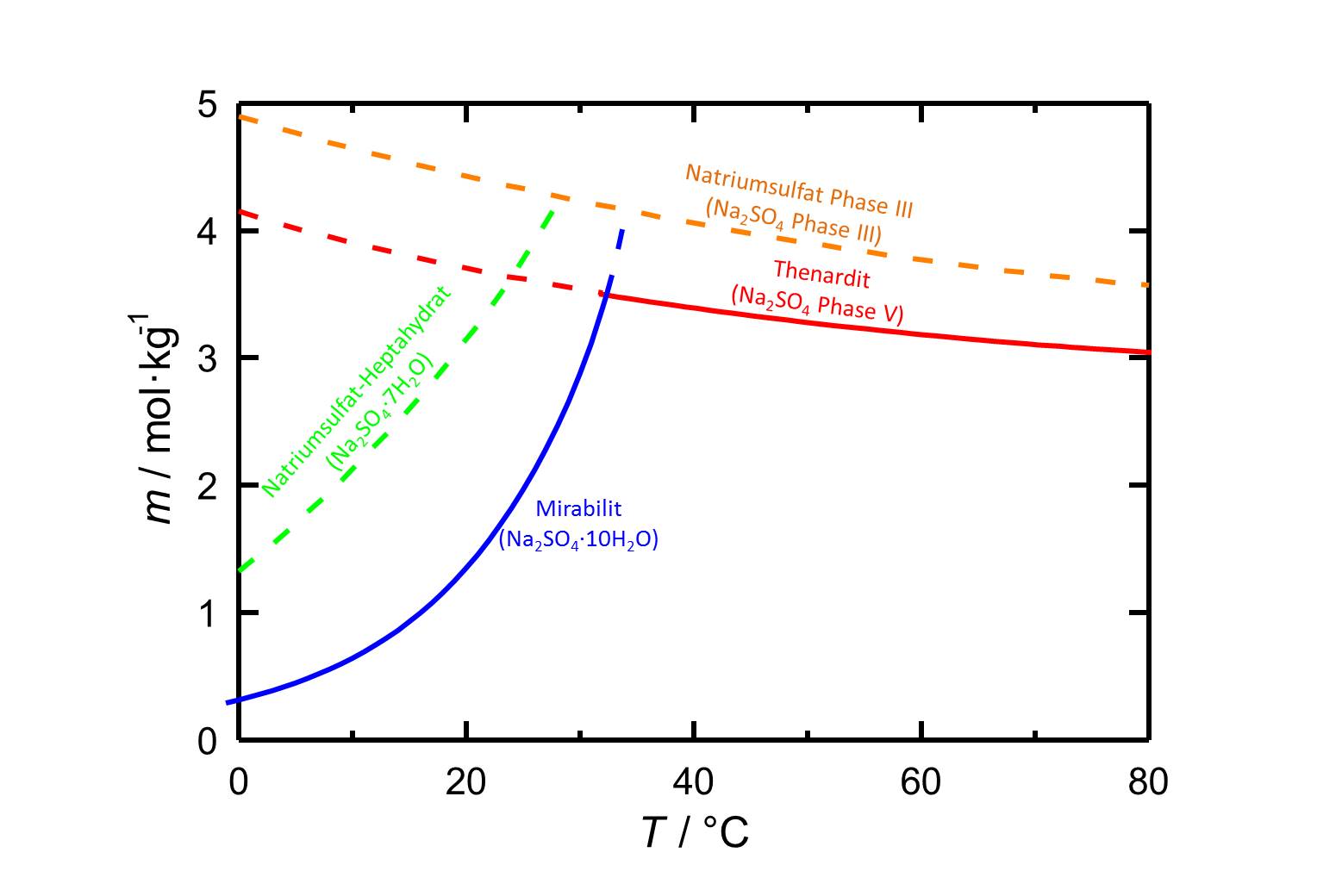
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
Die Phasen des Natriumsulfats gehören zu den leichtlöslichen Salzen und weisen somit eine hohe Mobilität in porösen Materialien auf. Die Löslichkeit der verschiedenen Phasen ist stark temperaturabhängig, wie es auch aus der Abbildung 1 hervorgeht. Darüber hinaus ist ersichtlich, dass Mirabilit nur bis zu einer Temperatur von 32,4 °C stabil ist. Bei höheren Temperaturen ist Thenardit die stabile kristalline Phase. Unterhalb dieser Umwandlungstemperatur ist widerum Thenardit metastabil. Bei einem Temperaturabfall einer in Bezug auf Thenardit gesättigten Lösung kann es zu hohen Übersättigungen der Lösung bezüglch Mirabilit kommen und somit zur Kristallisation von Mirabilit, womit ein gewisses Schädigungspotezial einhergeht.
| Phase | Löslichkeit [mol/kg] bei 20°C |
| Thenardit | 3,706 |
| Natriumsulfat Phase III | 4,428 |
| Natriumsulfat-Heptahydrat | 3,143 |
| Mirabilit | 1,353 |
Hygroskopizität[Bearbeiten]
In Abbildung 2 sind das Deliqueszenzverhalten der Natriumsulfatphasen in Abhängigkeit der Temperatur, sowie die Gleichgewichtsfeuchten der Thenardit-Mirabilit-Umwandlung aufgezeigt. Auch hier ist die Temperaturabhängigkeit zu erkennen. So sinkt die Deliqueszenzfeuchte von Mirabilit mit steigender Temperatur, die von Thenardit steigt hingegen, wenn auch nur geringfügig, mit ansteigender Temperatur.
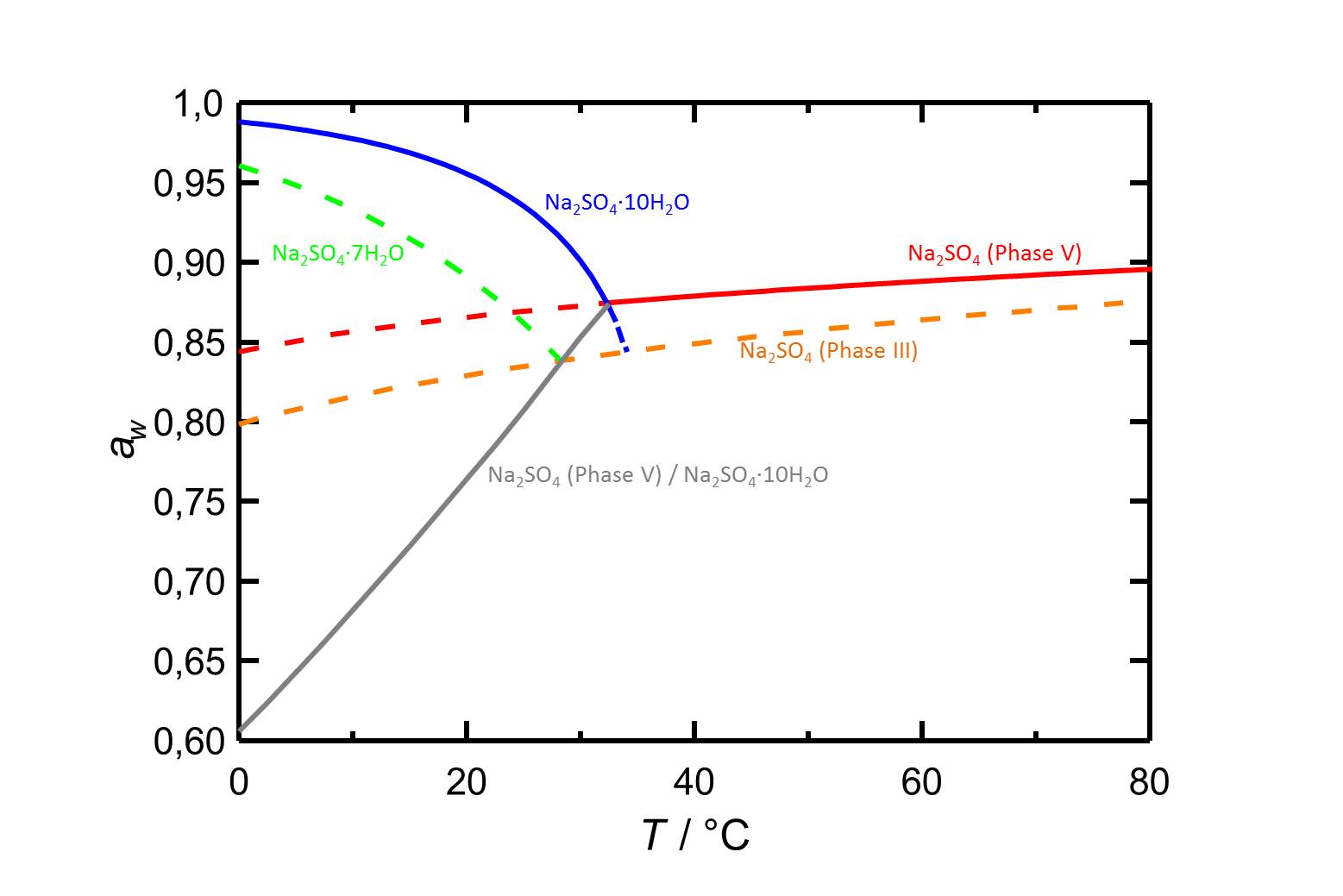
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
| Betrachtete Phasenübergänge | Deliqueszenz-/Gleichgewichtsfeuchte bei 20°C |
| Natriumsulfat Phase III-Lösung | 82,9 % |
| Thenardit-Lösung | 86,6 % |
| Natriumsulfat-Heptahydrat-Lösung | 89,1 % |
| Mirabilit-Lösung | 95,6 % |
| Thenardit-Mirabilit | 76,4 % |
Salze und Salzschäden im Bild[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
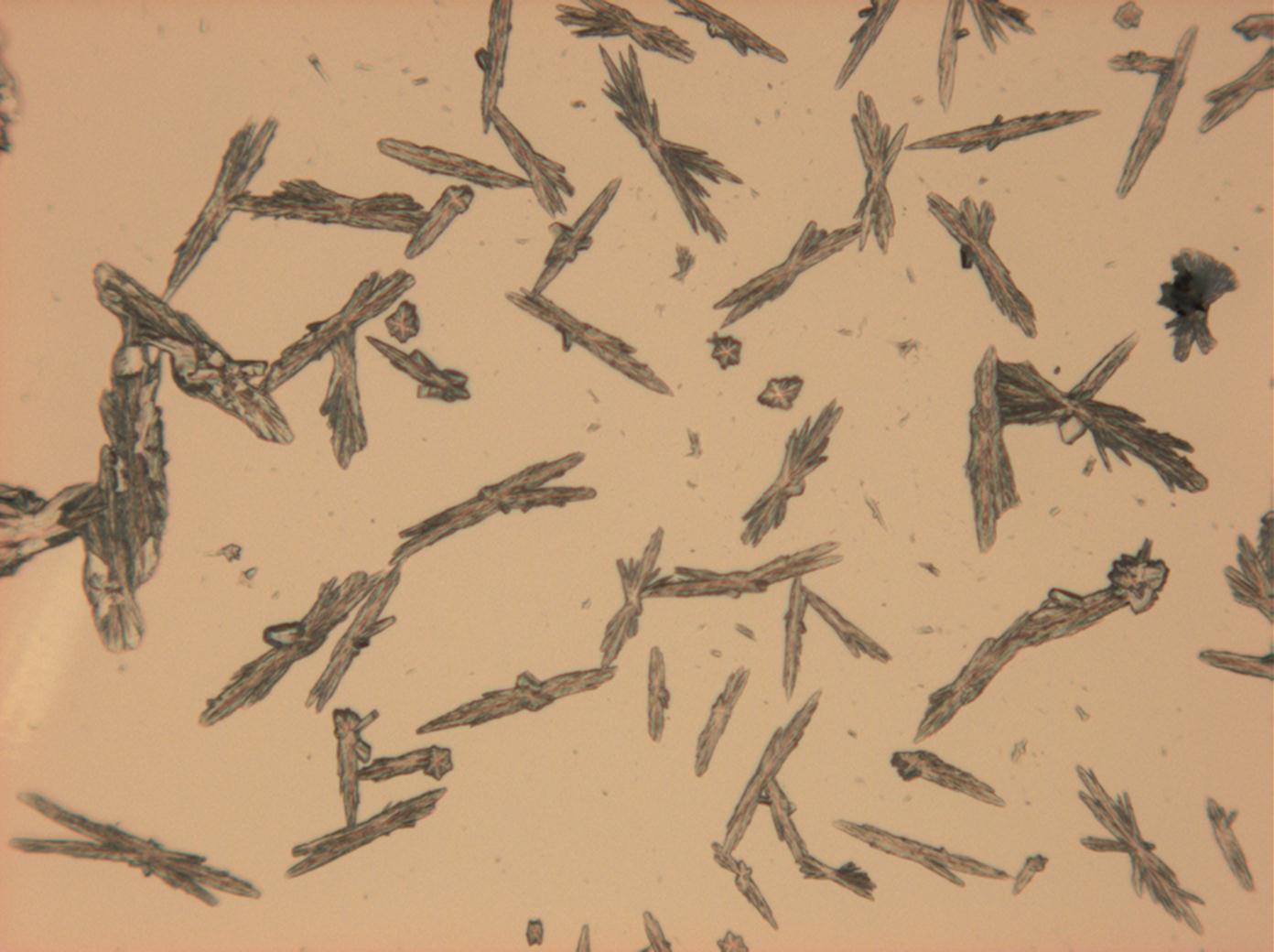
- Natriumsulfat-Kristalle zwischen zwei Objektträgern kristallisiert
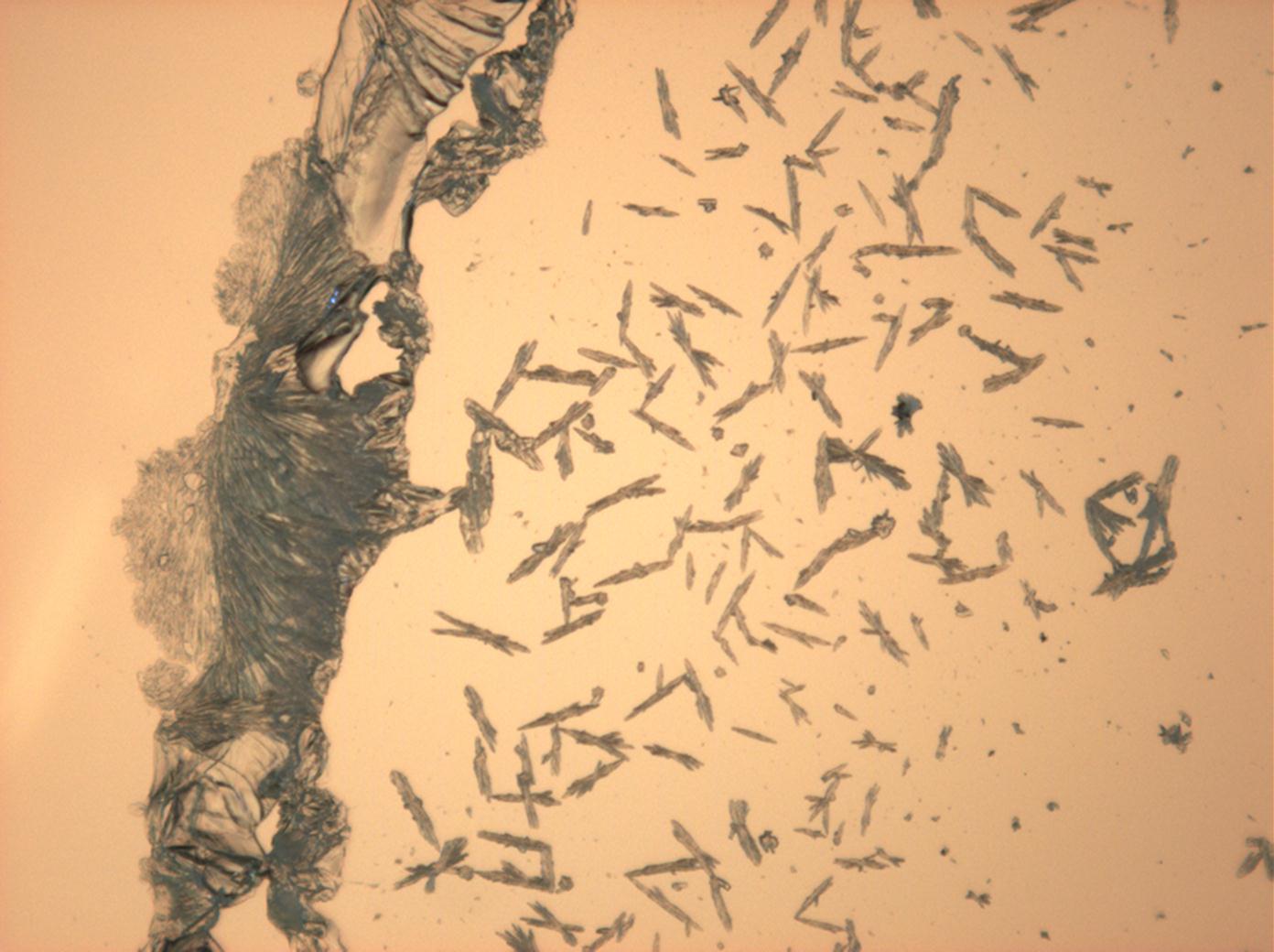
- Natriumsulfat-Kristalle, kristallisiert aus wässriger Lösung von Realproben
Weblinks[Bearbeiten]
Literatur[Bearbeiten]
| [Sperling.etal:1980] | Sperling, C.H.B.and Cooke, R.U. (1980): Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies. In: Papers in Geography, 8 () |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Winkler.etal:1970] | Winkler, Erhard M.; Wilhelm, E.J. (1970): Saltburst by Hydration Pressure in Architectural Stone in Urban Atmosphere. In: Geological Society of America, Bulletin, 81 (), 567-572 |  |
Weitere Literatur
| [Amirthalingam.etal:1977] | Amirthalingam V., Karkhanavala M. D., Rao U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Crystallographica Section A, 33 (3), 522-523, https://doi.org/10.1107/S0567739477001296 |  |
| [Amirthalingam:1977] | Amirthalingam, V.; Karkhanaavala, M. D.; Rao, U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Cryst., A33 (), 522-523 |  |
| [Bayh.etal:1966] | Bayh, W.; Haussuehl, Siegfried (1966): Elastische und mechanische Eigenschaften von Na2SO4 (Thenardit). In: Acta Crystallogr, 20 (6), 931-932 |  |
| [Bednarska.etal:2022] | Bednarska, D.; Koniorczyk, M.; Steiger, M. (2022): Identification of various salt crystallization and water freezing patterns induced by temperature variation from Na2SO4 – H2O system confined in porous materials. In: Construction and Building Materials, 347 (), Webadresse, https://doi.org/10.1016/j.conbuildmat.2022.128540 |  |
| [Brown.etal:2000] | Brown, P. W.; Badger, S. (2000): The distributions of bound sulfates and chlorides in concrete subjected to mixed NaCl, MgSO4, Na2SO4 attack. In: Cem. Concr. Res., 30 (10), 1535-1542 |  |
| [Brown.etal:2001] | Brown, P. W.; Badger, S. (2001): Reply to the discussion by William G. Hime and Stella L. Marusin of the paper "The distribution of bound sulfates and chlorides in concrete to mixed NaCl, MgSO4, Na2SO4 attack". In: Cem. Concr. Res., 31 (7), 1117-1118 |  |
| [CHEN.etal:2024] | Dong-Mei Chen; Kun Yuan; Xian-Ming Zhang (2024): Morphology transformation of Na2SO4 from prism into dendrite enhanced desalination efficiency in sandstone by biodegradable polycarboxylate modifiers. In: Construction and Building Materials, 411 (), 134513, Webadresse, https://doi.org/10.1016/j.conbuildmat.2023.134513 |  |
| [DeClercq.etal:2012] | Clercq, Hilde; Jovanović, Maja; Linnow, Kirsten; Steiger, Michael (2012): Performance of limestones laden with mixed salt solutions of Na2SO4–NaNO3 and Na2SO4–K2SO4. In: Environmental Earth Sciences, (), 1-11, Webadresse, 10.1007/s12665-012-2017-0 |  |
| [Donkers.etal:2015] | Donkers, P.; Linnow, K.; Pel, L.; Steiger, M.; Adan,O. (2015): Na2SO4·10H2O dehydration in view of thermal storage. In: Chemical Engineering Science, 134 (), 360-366, Webadresse, https://doi.org/10.1016/j.ces.2015.05.028 |  |
| [Freyer.etal:1997] | Freyer, D.; Fischer, St.; Koehnke, K.and Voigt W. (1997): Formation of double salt hydrates: I Hydration of quenched Na2SO4-CaSO4 phases. In: Solid State Ionics, 96 (2), 29-33, 10.1016/S0167-2738(96)00612-1, |  |
| [Friedel:1978] | Friedel, B. (1978): Gipslöslichkeiten in wässerigen Systemen mit NaCl, MgCl2, Na2SO4 und MgSO4. In: Zeitschrift für Pflanzenernährung und Bodenkunde, 141 (3), 337-346, 10.1002/jpln.19781410309 |  |
| [Granneman.etal:2019] | Granneman, S.J.C.; Lubelli, B.; van Hees, R.P.J. (2019): Effect of mixed in crystallization modifiers on the resistance of lime mortar against NaCl and Na2SO4 crystallization. In: Construction and Building Materials , 194 (), 62-70, Webadresse |  |
| [Lindstroem.etal:2014] | Lindström, N.; Talreja, T.; Linnow, K.; Steiger, M. (2014): Crystallization behavior of a Na2SO4–MgSO4 salt mixture and comparison to single salt behavior. In: Hilde De Clercq (Hrsg.): Proceedings of SWBSS 2014 3rd International Conference on Salt Weathering of Buildings and Stone Sculptures,KIK-IRPA, Royal Institute for Cultural Heritage Brussels 151-165, 10.5165/hawk-hhg/258. |   |
| [Lindstroem.etal:2015] | Nadine Lindström; Nicole Heitmann; Kirsten Linnow; Michael Steiger (2015): Crystallization behavior of NaNO3–Na2SO4 salt mixtures in sandstone and comparison to single salt behavior. In: Applied Geochemistry, 63 (), 116 - 132, Webadresse, https://doi.org/10.1016/j.apgeochem.2015.07.007 |  |
| [Lindstroen.etal:2016] | Nadine Lindström; Tanya Talreja; Kirsten Linnow; Amelie Stahlbuhk; Michael Steiger (2016): Crystallization behavior of Na2SO4–MgSO4 salt mixtures in sandstone and comparison to single salt behavior. In: Applied Geochemistry, 69 (), 50 - 70, Webadresse, https://doi.org/10.1016/j.apgeochem.2016.04.005 |  |
| [Linnow.etal:2012] | Linnow, Kirsten; Steiger, Michael; Lemster, Christine; Clercq, Hilde; Jovanović, Maja (2012): In situ Raman observation of the crystallization in NaNO3–Na2SO4–H2O solution droplets. In: Environmental Earth Sciences, (), 1-12, Webadresse, 10.1007/s12665-012-1997-0 |  |
| [Marliacy.etal:2000] | Marliacy, P.; Solimando, R.; Bouroukba, M.; Schuffenecker, L. (2000): Thermodynamics of crystallization of sodium sulfate decahydrate in H2O-NaCl-Na2SO4: application to Na2SO4.cntdot.10H2O-based latent heat storage materials. In: Thermochim. Acta, 344 (1), 85-94 |  |
| [Moffadel.etal:1991] | Moffadel, N.; Bouzaziz, R.; Mayer, M. (1991): Le polymorphisme du sulfate de sodum anhydre et les phases intermédiaries, glasérite et aphtitalite, dans le binaire Na2SO4-K2SO4. In: Thermochimica Acta, 185 (1), 141-153, 10.1016/0040-6031(91)80125-3 |  |
| [Naruse.etal:1987] | Naruse, H.; Tanaka, K.; Morikawa, H.; Marumo, F. (1987): Structure of Na2SO4(I) at 693 K. In: Acta Crystallographica, B43 (), 143-146 |  |
| [Nord:1973] | Nord, Anders G. (1973): Refinement of the Crystal Structure of Thenardite, Na2SO4(V). In: Acta Chem. Scand., 27 (3), 814-822 |  |
| [Platford:1975] | Platford, R. F. (1975): Thermodynamics of the system H2O-NaCl-MgCl2-Na2SO4-MgSO4 at 25 degrees C. In: Mar. Chem., 3 (4), 261-270 |  |
| [Potter.etal:1978] | Potter, R. W. I.; Clynne, M. A. (1978): Solubility of high soluble salts in aqueous media; Part 1, NaCl, KCl, CaCl2, Na2SO4, and K2SO4 solubilities to 100 degrees C. In: Journal of Research of the U. S. Geological Survey, 6 (6), 701-705 |  |
| [Ptacek.etal:1992] | Ptacek, C. J.; Reardon, E. J. (1992): Solubility of siderite (FeCO3) in concentrated NaCl and Na2SO4 solutions at 25 degrees C. In: Kharaka, Yousif K.; Maest, Ann S. (Hrsg.): Proceedings of the 7th international symposium on water-rock interaction, 181-184. |  |
| [Rard:1979] | Rard, J. A.; Miller, D. G. (1979): The mutual diffusion coefficients of Na2SO4-H2O and MgSO4-H2O at 25 degrees C from Rayleigh interferometry. In: J. Solut. Chem., 8 (10), 755-756 |  |
| [Rasmussen.etal:1996] | Rasmussen, Svend Erik; Jorgensen, Jens-Erik; Lundoft, Britta (1996): Structure and phase transition of Na2SO4. In: Journal of Applied Crystallography, 29 (), 42-47, 10.1107/S0021889895008818 |  |
| [Sarada.etal:1990] | Sarada, S.; Ananthaswamy, J. (1990): Thermodynamic Properties of Electrolyte Solutions: Emf Study of the System NaCl-Na2SO4-H20 at 25, 35 and 45 ÄC. In: Journal Chem. Soc. Faraday Trans., 86 (1), 81-84 |  |
| [Shen.etal:2020] | Shen, Y.; Linnow, K.; Steiger, M. (2020): Crystallization Behavior and Damage Potential of Na2SO4-NaCl Mixtures in Porous Building Materials. In: Crystal Growth & Design, 20 (9), 5974-5985, https://doi.org/10.1021/acs.cgd.0c00671 |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Tishchenko.etal:1992] | Tishchenko, Pavel Ya.; Bychkov, Alexander S.; Hravéczy-Páll, Andrea; Tóth, Klára; Pungor, Ernoe (1992): Activity Coefficients for the System NaCl + Na2SO4 + H2O at Various Temperatures. Application of Pitzer's Equations. In: Journal of Solution Chemistry, 21 (3), 261-274 |  |
| [Xu.etal:1999] | Xu B., Schweiger G. (1999): In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.. In: J. Aerosol. Sci., (), 379-380, Webadresse, https://doi.org/10.1016/S0021-8502(99)80201-8 |  |
| [Zdanovskii.etal:1991] | Zdanovskii, A. B.; Frolovskii, E. E. (1991): Equations for calculating the solubility of mirabilite in the aqueoussodium chloride-magnesium sulfate (2NaCl + MgSO4 = Na2SO4 + MgCl2) system at 0-25.degree. In: Zh. Prikl. Khim. (Leningrad), 64 (6), 1153-7 |  |