Halit: Unterschied zwischen den Versionen
Autor (Diskussion | Beiträge) (Die Seite wurde geleert.) |
Keine Bearbeitungszusammenfassung Markierung: Manuelle Zurücksetzung |
||
| (18 dazwischenliegende Versionen von 5 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz]], [[user:NMainusch|Nils Mainusch]] | |||
<br>zurück zu [[Chloride]] | |||
<br> | |||
{{Infobox_Salz | |||
|Footnote=<ref>http://webmineral.com/data/Halite.shtml gelesen 28.07.2010</ref><ref>http://www.mindat.org/min-1804.html gelesen 28.07.2010</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Halit gelesen 28.07.2010</ref><ref name=hydrohalit>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Hydrohalit gelesen 28.07.2010</ref> | |||
|bild =[[Image:NaCl 27.4.2006-10x.JPG|300px]] | |||
|mineralogischerName=Halit | |||
|chemischerName =Natriumchlorid | |||
|Trivialname =Kochsalz, Steinsalz | |||
|chemFormel =NaCl | |||
|Hydratformen =Natriumchlorid Dihydrat/Hydrohalit (NaCl•2H<sub>2</sub>O) | |||
|Kristallsystem =kubisch | |||
|Deliqueszenzfeuchte =75,4% | |||
|Löslichkeit=6,135 mol/kg | |||
|Dichte =2,163 g/cm<sup>3</sup> | |||
|Molvolumen =27,02 cm<sup>3</sup>/mol | |||
|Molgewicht =58,44 g/mol | |||
|Transparenz =durchsichtig bis durchscheinend | |||
|Spaltbarkeit =vollkommen | |||
|Kristallhabitus =kubische (würfelförmige) Kristalle; körnige, massige Aggregate | |||
|Zwillingsbildung =keine | |||
|Brechungsindices =n<sub>D</sub>=1,5443 | |||
|Doppelbrechung = | |||
|optOrientierung=isotrop | |||
|Pleochroismus = | |||
|Dispersion = | |||
|Phasenübergang = | |||
|chemVerhalten = | |||
|Bemerkungen =leicht wasserlöslich | |||
|Literatur =<bib id="Steiger.etal:2014"/> <bib id="Robie.etal:1978"/> <bib id="Dana:1951"/> | |||
}} | |||
== Abstract == | |||
== Vorkommen von Halit == | |||
Das gemeinhin als Speise- oder Streusalz verwendete Natriumchlorid wird auf dem Wege des bergmännischen Abbaus, der Gewinnung aus Meerwasser oder aus Salzseen nutzbar gemacht.<br> | |||
Der Gehalt an Natriumchlorid in Meerwasser liegt bei etwa 2,7 M.%.<br> | |||
== Angaben zu Herkunft und Bildung von Halit an Baudenkmalen == | |||
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumchlorid als Ausblühsalz entstehen. Anzuführen ist der hohe Gehalt von Natriumionen in Zementen. Der Eintrag von Natrium– und Chloridionen kann ferner durch belastetes Grund- und Oberflächenwasser erfolgen. Eine Fülle von Reinigungsmaterialien (wie Salzsäure, Abbeizprodukte) und v.a. früher verwendeten Restaurierungsmaterialien (wie Wasserglas) können Natrium – und Chloridionen in Baudenkmäler eintragen. Häufige Quelle für Halit ist ferner Streusalz, welches überwiegend aus Natriumchlorid besteht, und salzhaltiges Meerwasser bei Objekten in Küstennähe. | |||
== Lösungsverhalten == | |||
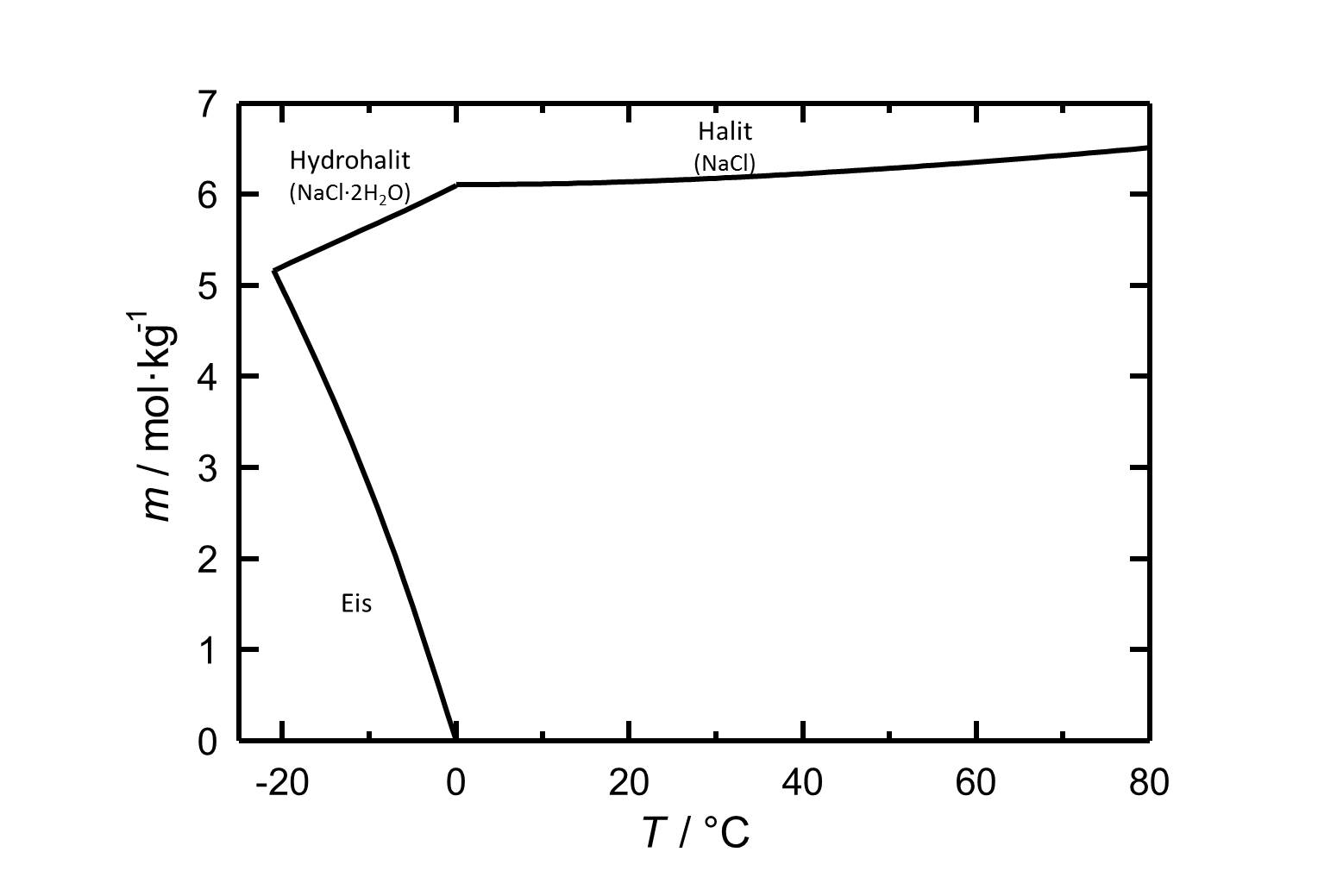
Der häufig auftretende Halit zählt mit einer Löslichkeit von 6.13 mol/kg (20°C) zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen. Die Löslichkeit verändert sich bei variierender Temperatur im Bereich 10-30°C vergleichsweise wenig. | |||
[[Image:L NaCl.jpg|thumb|left|800px|Abbildung 1:Löslichkeit von Natriumchlorid in Wasser. Aufgetragen ist die Molalität ''m'' [n(NaCl)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 1: Löslichkeit von Halit in Abhängigkeit zur Temperatur nach <bib id="Steiger.etal:2008c"/>. '' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Temperatur''' | |||
|bgcolor = "#F0F0F0" align=center| '''10°C''' | |||
|bgcolor = "#F0F0F0" align=center| '''20°C''' | |||
|bgcolor = "#F0F0F0" align=center| '''30°C''' | |||
|bgcolor = "#F0F0F0" align=center| '''40°C''' | |||
|- | |||
|bgcolor = "#F7F7F7" | Löslichkeit [mol/kg] | |||
|bgcolor = "#FFFFEO" align=center| 6,11 | |||
|bgcolor = "#FFFFEO" align=center| 6,13 | |||
|bgcolor = "#FFFFEO" align=center| 6,17 | |||
|bgcolor = "#FFFFEO" align=center| 6,22 | |||
|} | |||
<br clear=all> | |||
== Hygroskopizität == | |||
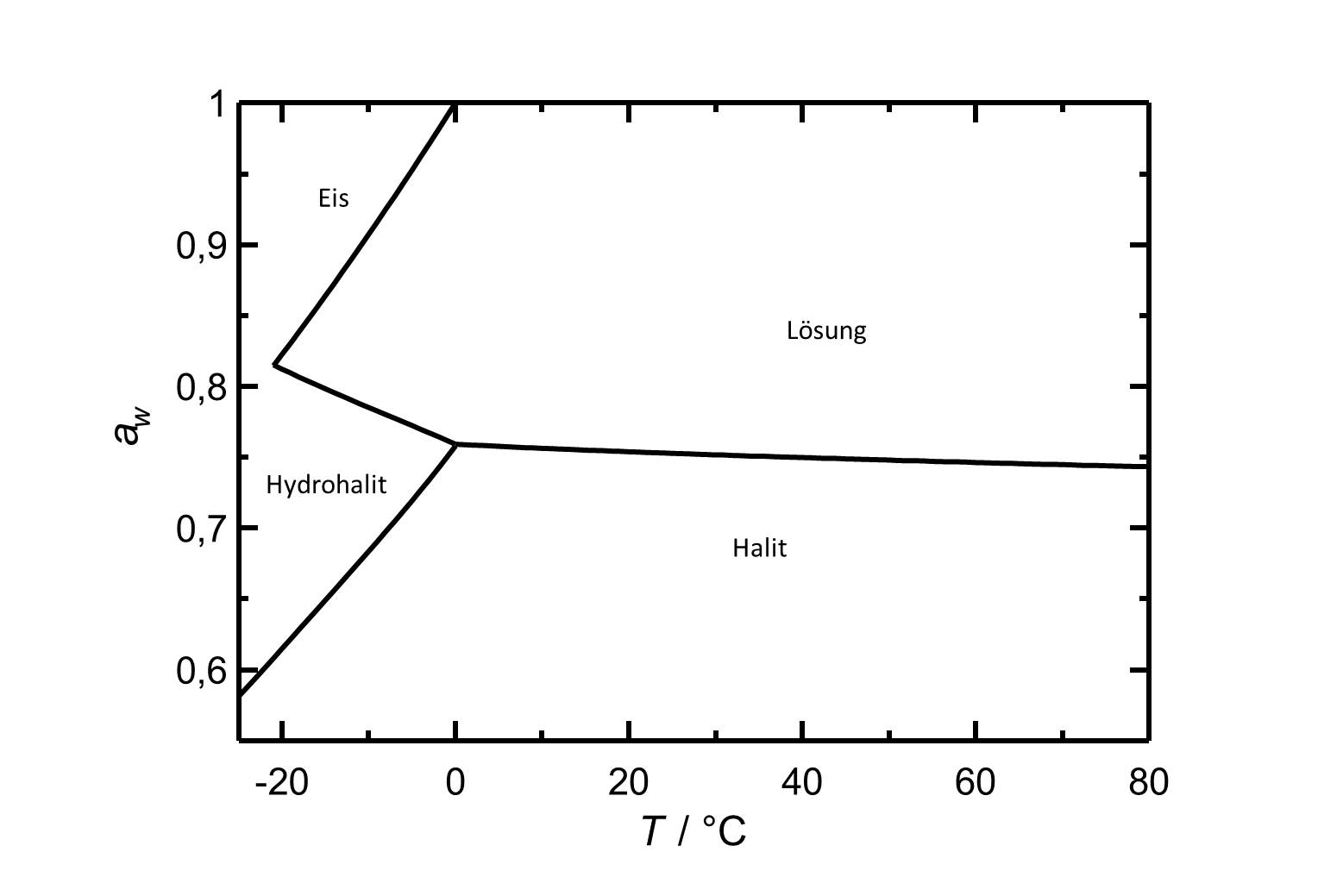
[[Image:D NaCl d.jpg|thumb|left|800px|Abbildung 2: Deliqueszenzverhalten von Natriumchlorid in Abhängigkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur.]] | |||
<br clear=all> | |||
Die Deliqueszenzfeuchte von Halit liegt mit einem Wert von ca. 75% in einem Bereich, der bei nordeuropäischen Klimaverhältnissen häufig durchlaufen wird. Temperaturschwankungen beeinflussen den Deliqueszenzpunkt von Halit wenig, anders als bei beispielsweise [[Niter]] oder [[Nitronatrit]]. | |||
<br clear=all> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 2: Deliqueszenzfeuchte von Natriumchlorid in Temperaturabhängigkeit nach <bib id="Steiger.etal:2014"/>'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| 0°C | |||
|bgcolor = "#F0F0F0" align=center| 10°C | |||
|bgcolor = "#F0F0F0" align=center| 20°C | |||
|bgcolor = "#F0F0F0" align=center| 30°C | |||
|bgcolor = "#F0F0F0" align=center| 40°C | |||
|bgcolor = "#F0F0F0" align=center| 50°C | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| 75,9%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 75,6%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 75,4%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 75,2%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 75,0%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 74,8%r.F. | |||
|} | |||
<br clear=all> | |||
<br> '''Feuchtesorption:'''<br>Theoretischen Berechnungen zufolge kann 1g NaCl 4,3g Feuchtigkeit aufnehmen. Nachstehend ist die Feuchtesorption bei variierenden relativen Feuchten wiedergegeben: | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | |||
|+''Tabelle 3:Feuchtesorption in M% nach 56 Tagen nach <bib id="Vogt.etal:1993"/> '' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Lagerungsfeuchte/Salzphase''' | |||
|bgcolor = "#F0F0F0" align=center| '''NaCl''' | |||
|- | |||
|bgcolor = "#F7F7F7" | '''87% r.F.''' | |||
|bgcolor = "#FFFFEO" align=center| 153 | |||
|- | |||
|bgcolor = "#F7F7F7" | '''81% r.F.''' | |||
|bgcolor = "#FFFFEO" align=center| 22 | |||
|- | |||
|bgcolor = "#F7F7F7" | '''79% r.F.''' | |||
|bgcolor = "#FFFFEO" align=center| 7 | |||
|} | |||
<br clear=all> | |||
== Kristallisationsdruck == | |||
Bei der Kristallisation aus wässeriger Lösung lässt sich für Halit ein Kristallisationsdruck von 55,4-65,4 N/mm<sup>2</sup> <bib id="Winkler:1975" /> angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm<sup>2</sup>). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch. | |||
== Hydratationsverhalten == | |||
Unter normalen Bedingungen existiert nur die hydratwasserfreie Form des Salzes. Lediglich beim Ausfall aus einer gesättigten, wässerigen Natriumchloridlösung und einer Temperatur von unter 0,15 °C bildet sich als Bodensatz das Dihydrat Hydrohalit | |||
<ref name=hydrohalit>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Hydrohalit gelesen 28.07.2010</ref>. | |||
<!-- | |||
=== Hydratationsdruck === | |||
=== Umwandlungsreaktionen === | |||
== <br>Analytischer Nachweis == | |||
--> | |||
== Mikroskopie == | |||
=== Laboruntersuchung === | |||
Natriumchloridkristalle sind mit großer Zuverlässigkeit anhand morphologischer Merkmale zu identifizieren. Einzelpartikel sind zumeist in Rechteck- oder in Würfelform/Oktaederform ausgebildet und weisen somit deutlich rechte Winkel im Kristallbau auf.<br> | |||
'''Brechungsindex:''' n<sub>D</sub> = 1,544<br>'''Kristallklasse:''' kubisch<br> | |||
'''Polarisationsmikroskopische Untersuchung:''' | |||
Natriumchlorid zählt wie Kaliumchlorid zu den wenigen bauschädlichen Salzen des kubischen Kristallsystems. Der Kristall zeigt aufgrund seines isotropen inneren Aufbaus keine Eigenschaften der Doppelbrechung. | |||
Die Zuweisung des Brechungsindex erfolgt entsprechend der Immersionsmethode in Standart- Immersionsöl mit einem Brechungsindex n<sub>D</sub> =1,518. Halitkristalle weisen in jeder möglichen Stellung die gleiche optische Dichte auf, wodurch es bei der Durchstrahlung von linear polarisiertem Licht zu keiner Geschwindigkeitsveränderung und Umorientierung der Lichtwellen kommt. Bei der Betrachtung mit gekreuzten Polarisatoren sind die Kristalle somit nicht erkennbar, sie verbleiben (richtungsunabhängig) ausgelöscht. | |||
<br> '''Verwechslungsmöglichkeiten:'''<br> | |||
Die Gruppe der isotropen bauschädlichen Salze beschränkt sich auf Halit, Sylvin und Fluorit; alle diese Phasen können problemlos voneinander unterschieden werden. | |||
<br clear="all"> | |||
{| cellspacing="1" cellpadding="1" border="1" style="width: 498px; height: 85px;" | |||
|+''Tabelle 4:Unterscheidungsmerkmale zu anderen Chloriden'' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Salzphase''' | |||
|bgcolor = "#F0F0F0"| '''Unterscheidungsmerkmale''' | |||
|- | |||
|bgcolor = "#F7F7F7"| [[Sylvin]] KCl | |||
|bgcolor = "#FFFFEO"| Brechungsindex unter 1,518. | |||
|- | |||
|bgcolor = "#F7F7F7"| [[Fluorit]] CaF<sub>2</sub> | |||
|bgcolor = "#FFFFEO"| Brechungsindex unter 1,518, kaum wasserlöslich. | |||
|} | |||
<!-- | |||
=== <br>Röntgendiffraktometrie === | |||
=== <br>Raman-Stektroskopie == | |||
=== DTA / TG === | |||
=== <br>IR-Spektroskopie === | |||
== <br>Umgang mit Halitschäden == | |||
--> | |||
== Salze und Salzschäden im Bild == | |||
=== Am Objekt === | |||
<gallery caption="" widths="200px" heights="150px" perrow="3"> | |||
Image:Strahlsund_Kochsalz-Kruste.jpg|Halit Kruste auf einer Ziegeloberfläche | |||
Image:Strahlsund_Kochsalz-Whisker.jpg|Halit Whisker | |||
</gallery> | |||
=== Unter dem Polarisationsmikrokop === | |||
<gallery caption="Auskristallisat aus wässrigen Proben auf Objektträger" widths="200px" heights="150px" perrow="3"> | |||
Image:NaCl 27.4.2006-10x (1).JPG|Natriumchlorid, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:NaCl 27.4.2006-10x (2).JPG|Natriumchlorid, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:NaCl 27.4.2006-10x (5).JPG|Natriumchlorid, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:NaCl 27.4.2006-10x (6).JPG|Natriumchlorid, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:NaCl 27.4.2006-10x.JPG|Natriumchlorid, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
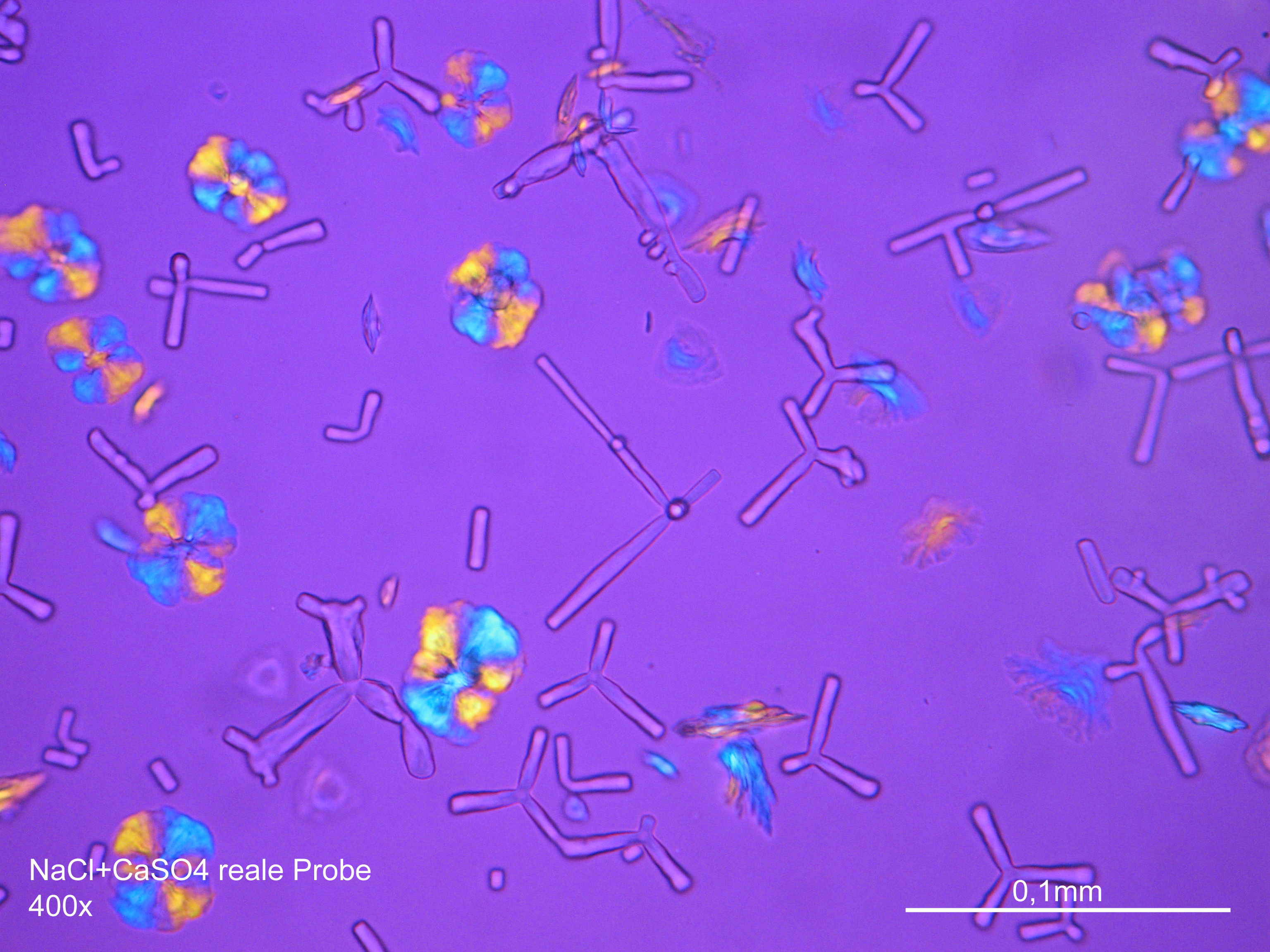
Image:NaCl+CaSO4 reale Probe 01.JPG|Natriumchlorid und Calciumsulfat in realer Probe, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:NaCl+CaSO4 reale Probe 02.JPG|Natriumchlorid und Calciumsulfat in realer Probe, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
</gallery> | |||
<!-- | |||
=== Unter dem Rasterelektronenmikroskop === | |||
--> | |||
== Weblinks == | |||
<references/> | |||
== Literatur == | |||
<!-- System NaCl-H2O wurde von BRAITSCH (1962) und FRENZEL (1980) --> | |||
<biblist/> | |||
'''Weitere Literatur''' | |||
<!-- | |||
<bibprint filter=" title:%NaCl%"/> | |||
--> | |||
[[Category:Halit]] [[Category:Mainusch,Nils]][[Category:Schwarz,Hans-Jürgen]] [[Category:R-MSteiger]] [[Category:Review]] [[Category:Chlorid]] [[Category:Salz]][[Category:Liste]] | |||
Aktuelle Version vom 6. März 2024, 08:04 Uhr
Autoren: Hans-Jürgen Schwarz, Nils Mainusch
zurück zu Chloride
| Halit[1][2][3][4] | |

| |
| Mineralogische Salzbezeichnung | Halit |
| Chemische Bezeichnung | Natriumchlorid |
| Trivialname | Kochsalz, Steinsalz |
| Chemische Formel | NaCl |
| Hydratformen | Natriumchlorid Dihydrat/Hydrohalit (NaCl•2H2O) |
| Kristallsystem | kubisch |
| Deliqueszenzfeuchte 20°C | 75,4% |
| Löslichkeit(g/l) bei 20°C | 6,135 mol/kg |
| Dichte (g/cm³) | 2,163 g/cm3 |
| Molares Volumen | 27,02 cm3/mol |
| Molare Masse | 58,44 g/mol |
| Transparenz | durchsichtig bis durchscheinend |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | kubische (würfelförmige) Kristalle; körnige, massige Aggregate |
| Zwillingsbildung | keine |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | leicht wasserlöslich |
| Kristalloptik | |
| Brechungsindices | nD=1,5443 |
| Doppelbrechung | |
| Optische Orientierung | isotrop |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Steiger.etal:2014]Titel: Weathering and Deterioration Autor / Verfasser: Steiger, Michael; Charola A. Elena; Sterflinger, Katja  [Robie.etal:1978]Titel: Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures [Robie.etal:1978]Titel: Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperaturesAutor / Verfasser: Robie R.A., Hemingway B.S.; Fisher J.A.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D. 
| |
Abstract[Bearbeiten]
Vorkommen von Halit[Bearbeiten]
Das gemeinhin als Speise- oder Streusalz verwendete Natriumchlorid wird auf dem Wege des bergmännischen Abbaus, der Gewinnung aus Meerwasser oder aus Salzseen nutzbar gemacht.
Der Gehalt an Natriumchlorid in Meerwasser liegt bei etwa 2,7 M.%.
Angaben zu Herkunft und Bildung von Halit an Baudenkmalen[Bearbeiten]
Durch den Eintrag von Materialien, die lösliche Natriumverbindungen enthalten, kann im mineralischen System eines Baudenkmals Natriumchlorid als Ausblühsalz entstehen. Anzuführen ist der hohe Gehalt von Natriumionen in Zementen. Der Eintrag von Natrium– und Chloridionen kann ferner durch belastetes Grund- und Oberflächenwasser erfolgen. Eine Fülle von Reinigungsmaterialien (wie Salzsäure, Abbeizprodukte) und v.a. früher verwendeten Restaurierungsmaterialien (wie Wasserglas) können Natrium – und Chloridionen in Baudenkmäler eintragen. Häufige Quelle für Halit ist ferner Streusalz, welches überwiegend aus Natriumchlorid besteht, und salzhaltiges Meerwasser bei Objekten in Küstennähe.
Lösungsverhalten[Bearbeiten]
Der häufig auftretende Halit zählt mit einer Löslichkeit von 6.13 mol/kg (20°C) zur Gruppe der leichtlöslichen und somit leicht mobilisierbaren Salzen. Die Löslichkeit verändert sich bei variierender Temperatur im Bereich 10-30°C vergleichsweise wenig.
| Temperatur | 10°C | 20°C | 30°C | 40°C |
| Löslichkeit [mol/kg] | 6,11 | 6,13 | 6,17 | 6,22 |
Hygroskopizität[Bearbeiten]
Die Deliqueszenzfeuchte von Halit liegt mit einem Wert von ca. 75% in einem Bereich, der bei nordeuropäischen Klimaverhältnissen häufig durchlaufen wird. Temperaturschwankungen beeinflussen den Deliqueszenzpunkt von Halit wenig, anders als bei beispielsweise Niter oder Nitronatrit.
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 75,9%r.F. | 75,6%r.F. | 75,4%r.F. | 75,2%r.F. | 75,0%r.F. | 74,8%r.F. |
Feuchtesorption:
Theoretischen Berechnungen zufolge kann 1g NaCl 4,3g Feuchtigkeit aufnehmen. Nachstehend ist die Feuchtesorption bei variierenden relativen Feuchten wiedergegeben:
| Lagerungsfeuchte/Salzphase | NaCl |
| 87% r.F. | 153 |
| 81% r.F. | 22 |
| 79% r.F. | 7 |
Kristallisationsdruck[Bearbeiten]
Bei der Kristallisation aus wässeriger Lösung lässt sich für Halit ein Kristallisationsdruck von 55,4-65,4 N/mm2 [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch.
angeben (zum Vergleich die berechneten Angaben der Werteskala anderer bauschädlichen Salze: 7,2-65,4 N/mm2). Zu berücksichtigen sind hierbei die vorliegenden Temperatur- und Konzentrationsverhältnisse, so dass die Zahlenwerte nur einen Hinweis auf ein reelles Schadenspotential in puncto Kristallisationsdruck des Salzes geben können. Im Vergleich zu anderen Salzphasen ist der Kristallisationsdruck extrem hoch.
Hydratationsverhalten[Bearbeiten]
Unter normalen Bedingungen existiert nur die hydratwasserfreie Form des Salzes. Lediglich beim Ausfall aus einer gesättigten, wässerigen Natriumchloridlösung und einer Temperatur von unter 0,15 °C bildet sich als Bodensatz das Dihydrat Hydrohalit [4].
Mikroskopie[Bearbeiten]
Laboruntersuchung[Bearbeiten]
Natriumchloridkristalle sind mit großer Zuverlässigkeit anhand morphologischer Merkmale zu identifizieren. Einzelpartikel sind zumeist in Rechteck- oder in Würfelform/Oktaederform ausgebildet und weisen somit deutlich rechte Winkel im Kristallbau auf.
Brechungsindex: nD = 1,544
Kristallklasse: kubisch
Polarisationsmikroskopische Untersuchung:
Natriumchlorid zählt wie Kaliumchlorid zu den wenigen bauschädlichen Salzen des kubischen Kristallsystems. Der Kristall zeigt aufgrund seines isotropen inneren Aufbaus keine Eigenschaften der Doppelbrechung.
Die Zuweisung des Brechungsindex erfolgt entsprechend der Immersionsmethode in Standart- Immersionsöl mit einem Brechungsindex nD =1,518. Halitkristalle weisen in jeder möglichen Stellung die gleiche optische Dichte auf, wodurch es bei der Durchstrahlung von linear polarisiertem Licht zu keiner Geschwindigkeitsveränderung und Umorientierung der Lichtwellen kommt. Bei der Betrachtung mit gekreuzten Polarisatoren sind die Kristalle somit nicht erkennbar, sie verbleiben (richtungsunabhängig) ausgelöscht.
Verwechslungsmöglichkeiten:
Die Gruppe der isotropen bauschädlichen Salze beschränkt sich auf Halit, Sylvin und Fluorit; alle diese Phasen können problemlos voneinander unterschieden werden.
| Salzphase | Unterscheidungsmerkmale |
| Sylvin KCl | Brechungsindex unter 1,518. |
| Fluorit CaF2 | Brechungsindex unter 1,518, kaum wasserlöslich. |
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikrokop[Bearbeiten]
- Auskristallisat aus wässrigen Proben auf Objektträger
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Halite.shtml gelesen 28.07.2010
- ↑ http://www.mindat.org/min-1804.html gelesen 28.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Halit gelesen 28.07.2010
- ↑ 4,0 4,1 http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Hydrohalit gelesen 28.07.2010
Literatur[Bearbeiten]
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |
| [Steiger.etal:2008c] | Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas (2008): An improved model incorporating Pitzer's equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code. In: Construction and Building Materials, 22 (8), 1841-1850, Webadresse, https://doi.org/10.1016/j.conbuildmat.2007.04.020 |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |
| [Winkler:1975] | Winkler, Erhard M. (1975): Stone: Properties, Durability in Man ´s Environment, Springer Verlag, Wien |  |
Weitere Literatur