Antarcticit: Unterschied zwischen den Versionen
Zur Navigation springen
Zur Suche springen
(Die Seite wurde neu angelegt: „Autoren: Hans-Jürgen Schwarz, Nils Mainusch, NN.... {| align="right" style="border: 2px solid rgb(224, 224, 224); padding: 5px; width: 38…“) |
|||
| (71 dazwischenliegende Versionen von 7 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: | Autoren: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz]] | ||
<br>zurück zu [[Chloride]] | |||
{| | {{Infobox_Salz | ||
|Footnote='<ref>http://webmineral.com/data/Antarcticite.shtml gesehen 29.07.2010</ref><ref name= mindat>http://www.mindat.org/min-251.html gesehen 29.07.2010</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Antarcticit gesehen 29.07.2010</ref> | |||
|bild =[[Image:HJS Ca(Cl)2 100903-10-7.jpg|300px]] | |||
| | |mineralogischerName=Antarcticit | ||
|chemischerName =Calciumchlorid Hexahydrat | |||
| | |Trivialname = | ||
| | |chemFormel =CaCl<sub>2</sub>•6H<sub>2</sub>O | ||
|Hydratformen = CaCl<sub>2</sub>•2H<sub>2</sub>O ([[Sinjarit]]) <br> CaCl<sub>2</sub>•4H<sub>2</sub>O ([[Calciumchlorid-Tetrahydrat]]) | |||
| | |Kristallsystem =trigonal | ||
|Deliqueszenzfeuchte =33,3% | |||
| | |Löslichkeit=6,712 mol/kg | ||
|Dichte =1,71 g/cm³ | |||
|Molvolumen =128,0 cm<sup>3</sup>/mol | |||
|Molgewicht =219,07 g/mol | |||
| | |Transparenz = | ||
|Spaltbarkeit =vollkommen | |||
|Kristallhabitus = | |||
|Zwillingsbildung = | |||
|Brechungsindices = n<sub>o</sub> =1,417-1,495<br> n<sub>e</sub> = 1,393-1,550 | |||
|Doppelbrechung =Δ= 0,055 | |||
|optOrientierung=einachsig negativ | |||
|Pleochroismus = | |||
| | |Dispersion = | ||
|Phasenübergang = | |||
| Deliqueszenzfeuchte | |chemVerhalten = | ||
|Bemerkungen =hygroskopisch bis zerfließend | |||
| | |Literatur =<bib id="Steiger.etal:2014"/> <bib id="Broul.etal:1981"/> | ||
| Dichte | }} | ||
__TOC__ | |||
| Molvolumen | <!-- | ||
== Abstract == | |||
| | |||
| | |||
| | |||
| | |||
| | |||
| | |||
| Doppelbrechung | |||
| | |||
| Pleochroismus | |||
| | |||
| | |||
| | |||
| | |||
| | |||
= <br>Einleitung = | = <br>Einleitung = | ||
| Zeile 81: | Zeile 41: | ||
== <br>Vorkommen von Antarcticit == | == <br>Vorkommen von Antarcticit == | ||
== <br>Angaben zu Herkunft und Bildung von Antarcticit an Baudenkmalen == | |||
<br> | = <br>Angaben zum Schadenspotential und zur Verwitterungsaktivität von Antarcticit = | ||
== <br> | == <br>Lösungsverhalten == | ||
< | (vgl.Tabelle [[Hygroskopizität der Salze und Gleichgewichtsfeuchte]])<bib id="DAns:1933"/> | ||
= | --> | ||
== Hygroskopizität == | |||
Zur Demonstration der Hygroskopizität von Salzlösungen wurde ein Becher mit konzentrierter CaCl<sub>2</sub>-Lösung mit einem Becher mit H<sub>2</sub>O in einen geschlossenen Raum gebracht und beobachtet. Das Video zeigt was geschehen ist. Dauer ca. 3 Tage. | |||
< | <!--[[File:Hygroscopic.ogg|400px]]--> | ||
== < | {|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | ||
|+''Tabelle 1: Deliqueszenzfeuchte von Antarcticit in Temperaturabhängigkeit nach <bib id="Steiger.etal:2014"/>'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| 0°C | |||
|bgcolor = "#F0F0F0" align=center| 10°C | |||
|bgcolor = "#F0F0F0" align=center| 20°C | |||
|bgcolor = "#F0F0F0" align=center| 30°C | |||
|bgcolor = "#F0F0F0" align=center| 40°C | |||
|bgcolor = "#F0F0F0" align=center| 50°C | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| 44,3%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 39,4%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 33,3%r.F. | |||
|bgcolor = "#FFFFEO" align=center| 21,6%r.F. (CaCl<sub>2</sub>•4H<sub>2</sub>O) | |||
|bgcolor = "#FFFFEO" align=center| 18,4%r.F. (CaCl<sub>2</sub>•4H<sub>2</sub>O) | |||
|bgcolor = "#FFFFEO" align=center| 16,3%r.F. (CaCl<sub>2</sub>•2H<sub>2</sub>O) | |||
|} | |||
<br> <br> | <br><br><br><br> | ||
'''Feuchtesorption:'''<br><br> | <!-- | ||
'''Feuchtesorption:'''<br><br> | |||
(vgl. Tabelle [[Gleichgewichtsfeuchte in Abhängigkeit von Temperatur]]) | |||
== <br>Kristallisationsdruck == | == <br>Kristallisationsdruck == | ||
<br> | == <br>Hydratationsverhalten == | ||
== <br> | == <br>Hydratationsdruck == | ||
== Umwandlungsreaktionen == | |||
PhasenDiagramm im System CaCl2 - H2O | |||
[[Datei:CaCl2_s-OO.jpg|thumb|400px| center|Löslichkeiten in Wasser/Phasen, Grafik M. Steiger]] | |||
= <br>Analytischer Nachweis = | = <br>Analytischer Nachweis = | ||
== <br>Mikroskopie<br> == | == <br>Mikroskopie<br> == | ||
'''Laboruntersuchung:''' <br> | '''Laboruntersuchung:''' <br> | ||
'''Brechungsindex:''' n<sub>D</sub> = 1<br>'''Kristallklasse:''' <br> | '''Brechungsindex:''' n<sub>D</sub> = 1<br>'''Kristallklasse:''' <br> | ||
| Zeile 137: | Zeile 115: | ||
| <br> | | <br> | ||
|} | |} | ||
== <br>Röntgendiffraktometrie == | == <br>Röntgendiffraktometrie == | ||
| Zeile 148: | Zeile 124: | ||
== <br>IR-Spektroskopie == | == <br>IR-Spektroskopie == | ||
= <br> | = Umgang mit Antarcticitschäden = | ||
--> | |||
<!-- | |||
== Salze und Salzschäden im Bild == | |||
--> | |||
<!-- | |||
=== Am Objekt === | |||
--> | |||
<br> | |||
== Unter dem Polarisationsmikrokop == | |||
<gallery caption="in einfach polarisiertem Licht" widths="200px" heights="200px" perrow="2"> | |||
Image:HJS Ca(Cl)2 100903-10-7.jpg | | |||
Image:HJS Ca(Cl)2 101603-4-3.jpg | | |||
Image:| | |||
Image: | | |||
</gallery> | |||
= | <gallery caption="unter gekreuzten Polarisatoren " widths="200px" heights="200px" perrow="1"> | ||
Image:HJS Ca(Cl)2 100903-10-1.jpg | |||
Image: | |||
Image: | |||
</gallery> | |||
< | <gallery caption="unter gekreuzten Polarisatoren (Rot I)" widths="200px" heights="200px" perrow="3"> | ||
Image:HJS Ca(Cl)2 100903-10-6.jpg | |||
Image:HJS Ca(Cl)2 101603-4-2.jpg | |||
Image:HJS Ca(Cl)2 101603-4-1.jpg | |||
</gallery> | |||
<!-- | |||
=== Unter dem Rasterelektronenmikroskop === | |||
--> | |||
== Weblinks == | |||
<references /> | |||
= | == Literatur == | ||
<biblist/> | |||
[[Category: | [[Category:Antarcticit]][[Category:Schwarz,Hans-Jürgen]][[Category:R-MSteiger]][[Category:Bearbeitung]] [[Category:Chlorid]] [[Category:Salz]] [[Category:Liste]] | ||
Aktuelle Version vom 3. Mai 2023, 11:41 Uhr
Autoren: Hans-Jürgen Schwarz
zurück zu Chloride
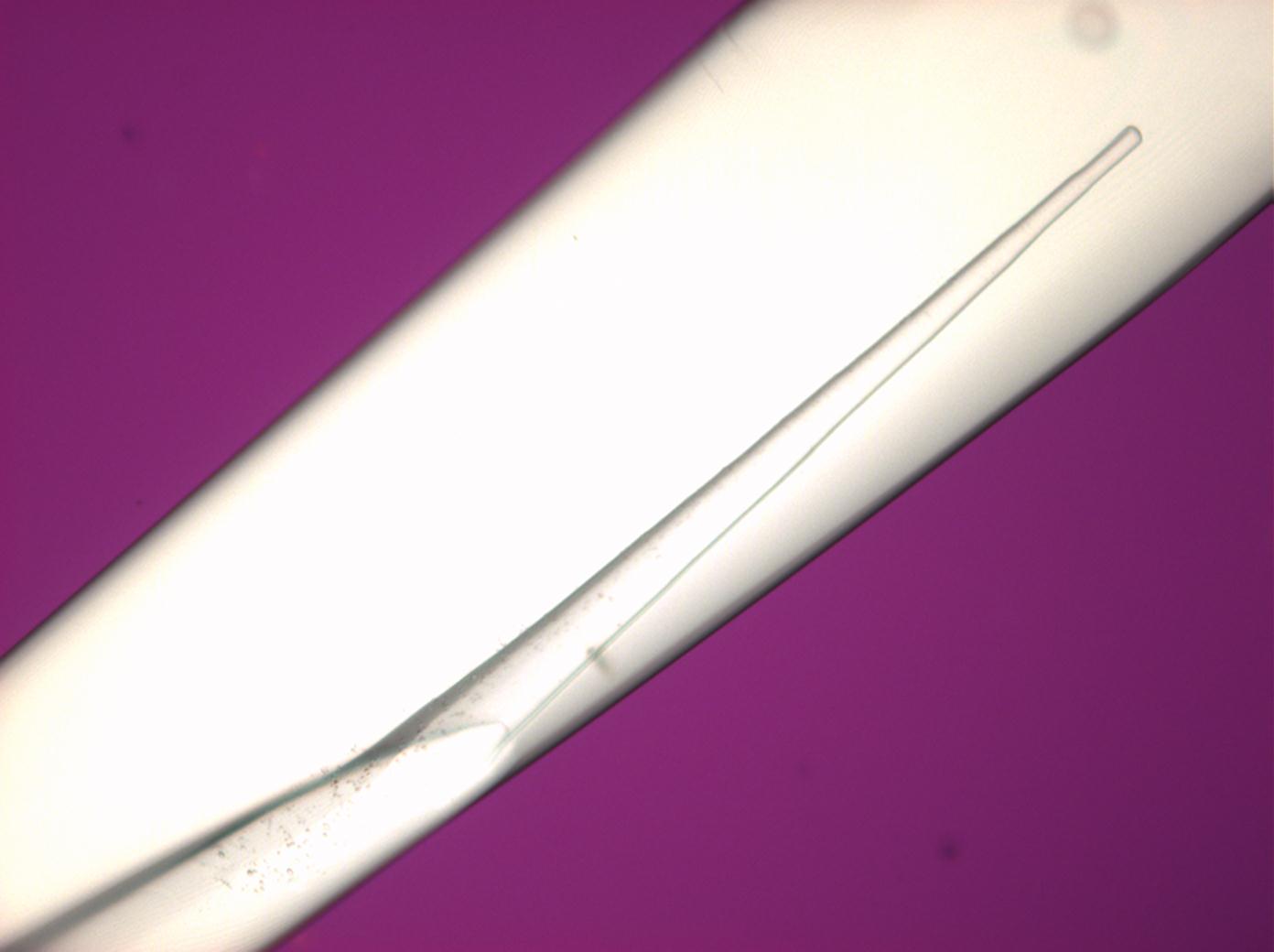
| Antarcticit'[1][2][3] | |
| |
| Mineralogische Salzbezeichnung | Antarcticit |
| Chemische Bezeichnung | Calciumchlorid Hexahydrat |
| Trivialname | |
| Chemische Formel | CaCl2•6H2O |
| Hydratformen | CaCl2•2H2O (Sinjarit) CaCl2•4H2O (Calciumchlorid-Tetrahydrat) |
| Kristallsystem | trigonal |
| Deliqueszenzfeuchte 20°C | 33,3% |
| Löslichkeit(g/l) bei 20°C | 6,712 mol/kg |
| Dichte (g/cm³) | 1,71 g/cm³ |
| Molares Volumen | 128,0 cm3/mol |
| Molare Masse | 219,07 g/mol |
| Transparenz | |
| Spaltbarkeit | vollkommen |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | hygroskopisch bis zerfließend |
| Kristalloptik | |
| Brechungsindices | no =1,417-1,495 ne = 1,393-1,550 |
| Doppelbrechung | Δ= 0,055 |
| Optische Orientierung | einachsig negativ |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Steiger.etal:2014]Titel: Weathering and Deterioration Autor / Verfasser: Steiger, Michael; Charola A. Elena; Sterflinger, Katja  [Broul.etal:1981]Titel: Solubility in organic two component systems [Broul.etal:1981]Titel: Solubility in organic two component systemsAutor / Verfasser: Broul M., Nyvlt J.; Soehnel O. 
| |
Hygroskopizität[Bearbeiten]
Zur Demonstration der Hygroskopizität von Salzlösungen wurde ein Becher mit konzentrierter CaCl2-Lösung mit einem Becher mit H2O in einen geschlossenen Raum gebracht und beobachtet. Das Video zeigt was geschehen ist. Dauer ca. 3 Tage.
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 44,3%r.F. | 39,4%r.F. | 33,3%r.F. | 21,6%r.F. (CaCl2•4H2O) | 18,4%r.F. (CaCl2•4H2O) | 16,3%r.F. (CaCl2•2H2O) |
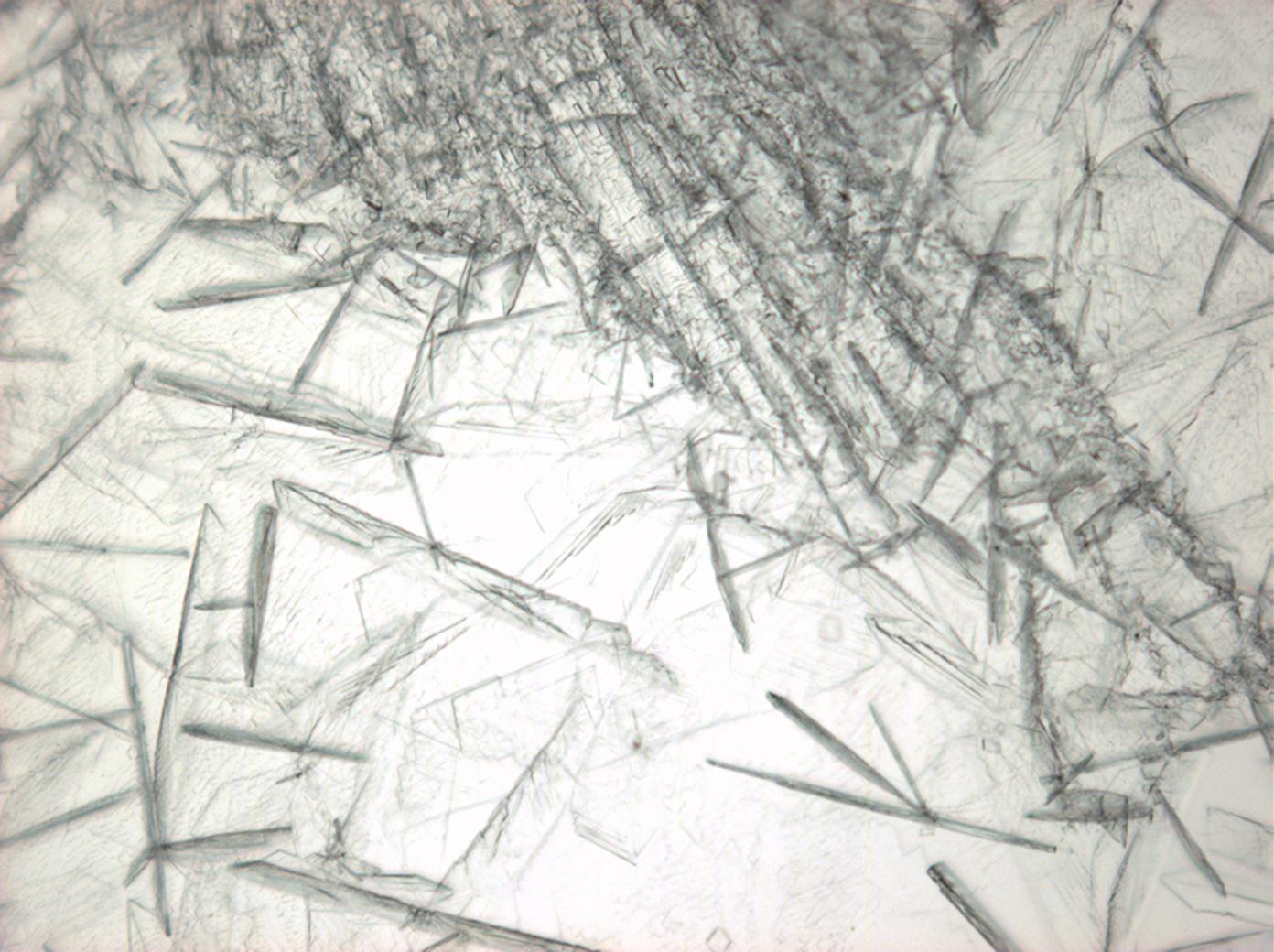
Unter dem Polarisationsmikrokop[Bearbeiten]
- in einfach polarisiertem Licht
- unter gekreuzten Polarisatoren
- unter gekreuzten Polarisatoren (Rot I)
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Antarcticite.shtml gesehen 29.07.2010
- ↑ http://www.mindat.org/min-251.html gesehen 29.07.2010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Antarcticit gesehen 29.07.2010
Literatur[Bearbeiten]
| [Broul.etal:1981] | Elsevier (Hrsg.) Broul M., Nyvlt J.; Soehnel O. (1981): Solubility in organic two component systems, Elsevier |  |
| [DAns:1933] | d'Ans, J. (1933): Die Lösungsgleichgewichte der Systeme der Salze ozeanischer Salzablagerungen, Verlagsgesellschaft für Ackerbau, M.B.H. Berlin |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (Hrsg.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, Webadresse, https://doi.org/10.1007/978-3-642-45155-3_4. |  |