Epsomit: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (148 dazwischenliegende Versionen von 6 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: Hans-Jürgen Schwarz , Nils Mainusch | Autoren: [[Benutzer:Hschwarz|Hans-Jürgen Schwarz]], [[Benutzer:TMueller|Tim Müller]], [[user:NMainusch|Nils Mainusch]] | ||
<br>zurück zu [[Sulfate]] | |||
= <br> | {{Infobox_Salz | ||
|Footnote=<ref>http://webmineral.com/data/Epsomite.shtml gesehen 29.072010</ref><ref>http://www.mindat.org/min-1393.html gesehen 29.072010</ref><ref>http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Epsomit gesehen 29.072010</ref> | |||
|bild =[[Datei:HJS MgSO4 092503-2.jpg|300px]] | |||
|mineralogischerName=Epsomit | |||
|chemischerName =Magnesiumsulfat Heptahydrat | |||
|Trivialname =Bittersalz, Gletschersalz, Reichardit | |||
|chemFormel =MgSO<sub>4</sub>•7H<sub>2</sub>O | |||
|Hydratformen =[[Kieserit]] (MgSO<sub>4</sub>•H<sub>2</sub>O)<br>[[Sanderit]] (MgSO<sub>4</sub>•2H<sub>2</sub>O)<br>[[Starkeyit]] (MgSO<sub>4</sub>•4H<sub>2</sub>O)<br>[[Pentahydrit]] (MgSO<sub>4</sub>•5H<sub>2</sub>O)<br>[[Meridianiit]] (MgSO<sub>4</sub>•11H<sub>2</sub>O)<br> [[Magnesium 12-Hydrat]] | |||
|Kristallsystem =orthorhombisch | |||
|Deliqueszenzfeuchte =91,3 % | |||
|Löslichkeit=2,839 mol/kg | |||
|Dichte =1,68 g/cm<sup>3</sup> | |||
|Molvolumen =146,8 cm<sup>3</sup>/mol | |||
|Molgewicht =246,48 g/mol | |||
|Transparenz =durchsichtig bis durchscheinend | |||
|Spaltbarkeit =deutlich bis vollkommen | |||
|Kristallhabitus =kleine, nadelige oder faserige Kristalle, körnige Aggregate, Krusten | |||
|Zwillingsbildung =selten | |||
|Brechungsindices =n<sub>x</sub> = 1,432<br> n<sub>y</sub> = 1,453<br> n<sub>z</sub> = 1,4609 | |||
|Doppelbrechung =Δ = 0,0284 | |||
|optOrientierung=zweiachsig negativ | |||
|Pleochroismus =keiner | |||
|Dispersion =51,5° | |||
|Phasenübergang = | |||
|chemVerhalten = | |||
|Bemerkungen =herzustellen in wässriger Lösung unter 50°C | |||
|Literatur =<bib id="Steiger.etal:2011"/> <bib id="Lide:1995"/> <bib id="Dana:1951"/> | |||
}} | |||
__TOC__ | |||
= | <!--== Abstract == --> | ||
== | == Einleitung == | ||
== | |||
== Vorkommen von Epsomit == | |||
Als natürliches Mineral wurde Epsomit im Jahr 1695 erstmalig aus den Mineralwässern des Ortes Epsom (bei London) gewonnen, woher die mineralogische Namensgebung rührt. Ebenso wie [[Kieserit]] (Magnesiumsulfatmonohydrat) treten Einzelkristalle in der Natur selten auf. Beide Magnesiumsalze wie auch weitere Hydratstufen werden in alpinen Lagerstätten abgebaut und erscheinen zusammen mit [[Sylvin]] und [[Halit|Steinsalz]] in Norddeutschland und in den Abraumsalzen des Staßfurter Gebietes (bei Magdeburg). | |||
== Angaben zu Herkunft und Bildung von Epsomit an Baudenkmalen == | |||
Die Bildung von Magnesiumsulfaten an Denkmalen setzt das Vorhandensein löslicher Magnesiumverbindungen, bzw. von Magnesiumionen voraus. An historischen Bauten können unterschiedliche Materialien Verwendung finden, in denen Magnesiumverbindungen enthalten sind. Einige Beispiele seien nachfolgend aufgeführt:<br> | Die Bildung von Magnesiumsulfaten an Denkmalen setzt das Vorhandensein löslicher Magnesiumverbindungen, bzw. von Magnesiumionen voraus. An historischen Bauten können unterschiedliche Materialien Verwendung finden, in denen Magnesiumverbindungen enthalten sind. Einige Beispiele seien nachfolgend aufgeführt:<br> | ||
*Verwendung von Kalk mit dolomitischem Anteil: Dolomit ist ein Doppelsalz der Zusammensetzung CaMg(CO<sub>3</sub>)<sub>2</sub>. Wird dolomithaltiger Kalk gebrannt, gelöscht und als Mörtelmischung verwendet, liegt nach dem | *'''Verwendung von Kalk mit dolomitischem Anteil''': [[Dolomit]] ist ein Doppelsalz der Zusammensetzung CaMg(CO<sub>3</sub>)<sub>2</sub>. Wird dolomithaltiger Kalk gebrannt, gelöscht und als Mörtelmischung verwendet, liegt nach dem Prozess der Carbonatisierung sowohl CaCO<sub>3</sub> wie auch MgCO<sub>3</sub>·xH<sub>2</sub>0 vor (beispielsweise in Form von [[Nesquehonit]], also mit drei Kristallwassermolekülen in der Form MgCO<sub>3</sub>·3H<sub>2</sub>0). Die Wasserlöslichkeit von MgCO<sub>3</sub>·3H<sub>2</sub>0 liegt mit ca. 1,76 g/l deutlich über den Löslichkeiten von [[Calcit]] (0,014 g/l) und [[Dolomit]] (0,078 g/l). Durch Feuchteeinwirkung gelöste Magnesiumionen können mit entsprechenden Anionen verschiedene Magnesiumsalze bilden. Die Bildung von Magnesiumsulfat kann forciert erfolgen, wenn in Verbindung mit dolomithaltigem Verputz Stuckgips oder Gipsputz am Objekt verwendet wurde und somit Sulfat im Überschuss vorliegt. | ||
*Verwendung von Magnesiabinder: Magnesiabinder besteht im wesentlichen aus MgO und MgCl<sub>2</sub> oder Magnesiumsulfat. Das ausreagierte und verfestigte Bindemittel kann stark hygroskopische Magnesiumsalze enthalten, welche zu Magnesiumsulfat umgebildet werden können. | *'''Verwendung von Magnesiabinder''': Magnesiabinder besteht im wesentlichen aus MgO und MgCl<sub>2</sub> oder Magnesiumsulfat. Das ausreagierte und verfestigte Bindemittel kann stark hygroskopische Magnesiumsalze enthalten, welche zu Magnesiumsulfat umgebildet werden können. | ||
*Verwendung von Zement: Nach DIN 1164 ist in Zementen eine Höchstgehalt an MgO von 5 M.% zugelassen. Außer der Möglichkeit bei zeitverzögert verlaufendem Ablöschen durch sogenanntes „Magnesiatreiben“ Schäden zu verursachen, können theoretisch Magnesiumionen freigesetzt werden und zur Bildung von Magnesiumsulfat führen. | *'''Verwendung von Zement''': Nach DIN 1164 <bib id="DIN1164:1994"/> ist in Zementen eine Höchstgehalt an MgO von 5 M.% zugelassen. Außer der Möglichkeit bei zeitverzögert verlaufendem Ablöschen durch sogenanntes „Magnesiatreiben“ Schäden zu verursachen, können theoretisch Magnesiumionen freigesetzt werden und zur Bildung von Magnesiumsulfat führen. | ||
Als weitere Quelle einer möglichen Magnesiumsulfatbildung ist Streusalz anzuführen, welches oft einen geringen Anteil des leichtlöslichen | Als weitere Quelle einer möglichen Magnesiumsulfatbildung ist Streusalz anzuführen, welches oft einen geringen Anteil des leichtlöslichen MgCl<sub>2</sub> enthält. Weiterhin kann eine Magnesiumzufuhr durch stete Bodenauslaugung bei aufsteigender Feuchte erfolgen. | ||
<br> | <br> | ||
= | == Lösungsverhalten == | ||
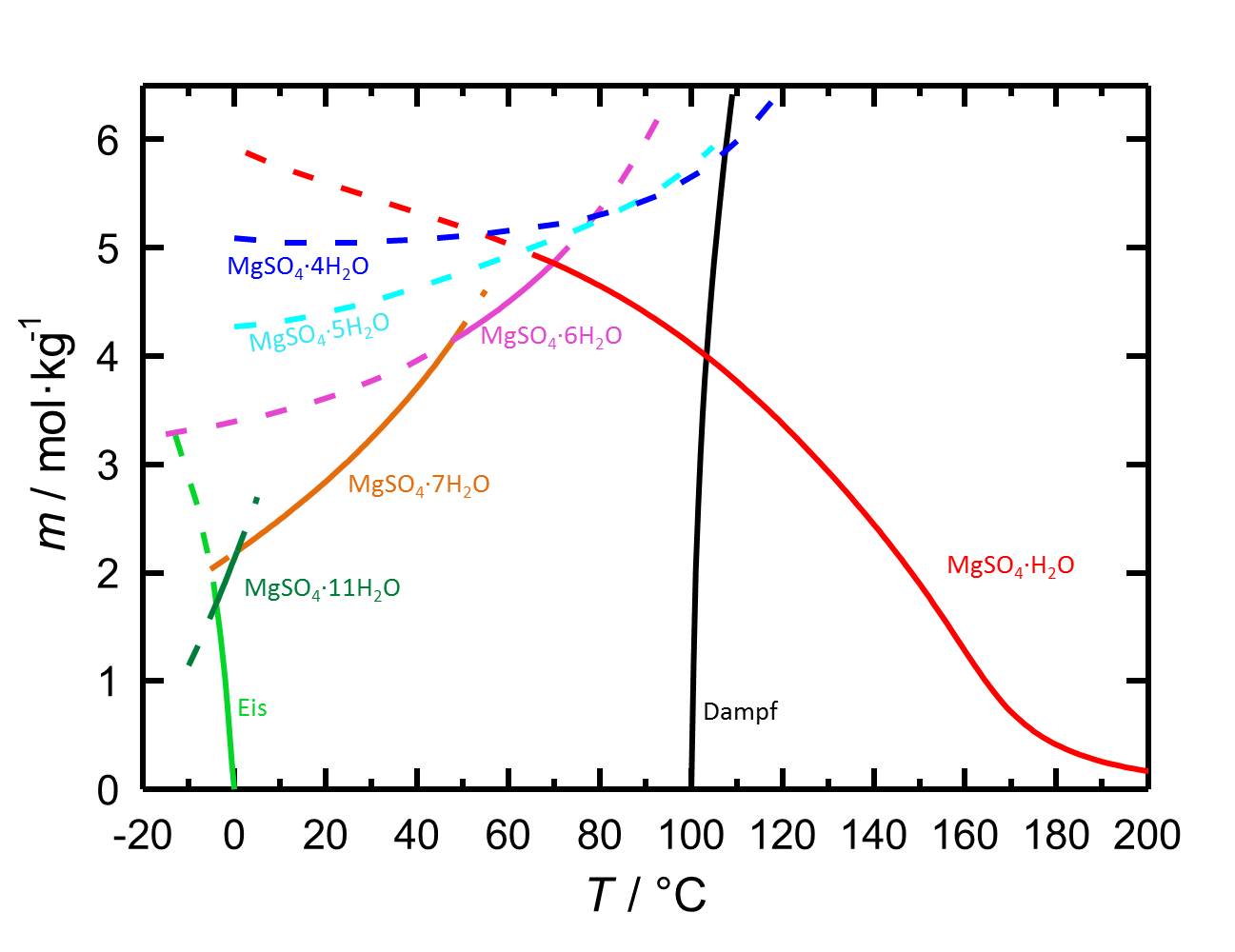
[[Datei:L MgSO4.jpg|thumb|778px|left|'''Abbildung 1''': Löslichkeiten von MgSO<sub>4</sub> in Wasser in Abhängigkeit der Temperatur. Aufgetragen ist die Molalität ''m'' [n(MgSO<sub>4</sub>•xH<sub>2</sub>O)•kg(H<sub>2</sub>O)<sup>-1</sup>] gegen die Temperatur.]] | |||
<br clear="all"> | |||
Alle oben beschriebenen Magnesiumsulfathydratformen zählen mit einer Löslichkeit von deutlich über 100 g/l (bei 20°C) zur Gruppe der leichtlöslichen Salze. Damit ist im Prinzip eine große Mobilität des Salzes und eine häufige Verschiebung der Anreicherungszonen im Materialgefüge verbunden. Mit dem Temperatureinfluss auf die Löslichkeit kann die Gefahr eines Ausfallens gelöster Salze bei raschem Temperaturabfall verbunden sein. | |||
<br> | |||
== Hygroskopizität == | |||
<br> | Die geringe Hygroskopizität des Reinsalzes Epsomit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich 88-90 % r.F. deutlich wird, kann nicht isoliert betrachtet werden. In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunkt tiefer (siehe Tab.). Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben. <br> | ||
<br clear="all"> | |||
[[File:D MgSO4 deutsch.jpg|thumb|800px|left|'''Abbildung 2:''' Deliqueszenzverhalten des Systems MgSO<sub>4</sub>-H<sub>2</sub>O in Abhängingkeit der Temperatur. Aufgetragen ist die Wasseraktivität ''a<sub>w</sub>'' gegen die Temperatur. Gleichgewichtsfeuchten und Deliqueszenzfeuchten der verschiedenen Phasen sind durch unterschiedliche Farben gekennzeichnet. Gestrichelte Kurven markieren metastabile Gleichgewichte. Nach <bib id="Steiger.etal:2011a"/>.]] | |||
<br clear="all"> | |||
{| | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 1:Deliqueszenzfeuchte in Abhängigkeit der Temperatur [nach <bib id="Steiger.etal:2011a" />]'' <!-- Tabellenüberschrift einfügen --> | |||
|- | |- | ||
| 10°C | |bgcolor = "#F0F0F0" align=center| 10°C | ||
| 20°C | |bgcolor = "#F0F0F0" align=center| 20°C | ||
| | |bgcolor = "#F0F0F0" align=center| 25°C | ||
| 30°C | |bgcolor = "#F0F0F0" align=center| 30°C | ||
|- | |- | ||
| | |bgcolor = "#FFFFEO" align=center| 93,7% r.F. | ||
| | |bgcolor = "#FFFFEO" align=center| 91,3% r.F. | ||
| | |bgcolor = "#FFFFEO" align=center| 90,3% r.F. | ||
| | |bgcolor = "#FFFFEO" align=center| 89,1% r.F. | ||
|} | |} | ||
<br> | <br> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 2: Gleichgewichtsfeuchte im Salzgemisch (Mischungsverhältnis: Gesättigte Lsg. A/ gesättigte Lsg. B =1:1) [nach <bib id="Vogt.etal:1993" />]'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| | |||
|bgcolor = "#F0F0F0" align=center| '''Ca(NO<sub>3</sub>)<sub>2</sub>''' | |||
|bgcolor = "#F0F0F0" align=center| '''KNO<sub>3</sub>''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| '''MgSO<sub>4</sub> xH<sub>2</sub>O''' | |||
|bgcolor = "#FFFFEO" align=center| 67 (21°C) | |||
|bgcolor = "#FFFFEO" align=center| 78(21°C) | |||
|} | |||
<br clear="all"> | |||
{| cellspacing=" | ===Feuchtesorption=== | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | |||
|+''Tabelle 3:Sorptionsverhalten von Magnesiumsulfat [nach <bib id="Vogt.etal:1993"/>]'' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Lagerungsfeuchte''' | |||
|bgcolor = "#F0F0F0"| '''87%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''81%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''70%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''61%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''50%r.F.''' | |||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''MgSO<sub>4</sub>''' | ||
| | |bgcolor = "#FFFFEO" align=center| 76 | ||
| | |bgcolor = "#FFFFEO" align=center| 75 | ||
|bgcolor = "#FFFFEO" align=center| 70 | |||
|bgcolor = "#FFFFEO" align=center| 71 | |||
|bgcolor = "#FFFFEO" align=center| 27 | |||
|- | |- | ||
| | |bgcolor = "#F7F7F7"| '''MgSO<sub>4</sub> + NaCl'''<br>(1:1 molare Mischung) | ||
| | |bgcolor = "#FFFFEO" align=center| 240 | ||
| | |bgcolor = "#FFFFEO" align=center| 146 | ||
|bgcolor = "#FFFFEO" align=center| 75 | |||
|bgcolor = "#FFFFEO" align=center| 50 | |||
|bgcolor = "#FFFFEO" align=center| 20 | |||
|} | |} | ||
<br clear="all"> | |||
== Kristallisationsdruck == | |||
Aufgrund der leichten Löslichkeit des Salzes treten bei entsprechenden Feuchteverhältnissen Lösungs- und Rekristallisationsvorgänge ein. Der dabei (theoretisch berechenbare) Kristallisationsdruck liegt bei Epsomit zwischen 10,5-12,5 N/mm<sup>2 </sup>und bei [[Hexahydrit]] zwischen 11,8- 14,1 N/mm<sup>2</sup>. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte somit im unteren Drittel einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm<sup>2</sup> reicht [nach <bib id="Winkler:1975"/>] | |||
== Hydratationsverhalten == | |||
Das System MgSO<sub>4</sub> – H<sub>2</sub>O: Als stabile Verbindungen sind die oben aufgelisteten sechs Hydratstufen des Magnesiumsulfates belegt. Mit der Ausnahme des Magnesiumsulfat-12-Hydrates wurden alle oben aufgeführten Kristallwasserstufen des Magnesiumsulfates an Baudenkmalen nachgewiesen, wobei im wesentlichen jedoch nur Epsomit, [[Hexahydrit]], [[Pentahydrit]] und [[Kieserit]] auftreten. | |||
Epsomit stellt bei Raumtemperatur und einer relativen Feuchte im Bereich von 50%-90% die beständigste Hydratstufe dar. Sinkt die relative Feuchte bei Raumtemperatur deutlich unter 50%, dann kommt es zu Kristallwasserabgabe und der Bildung niedrigerer Hydratstufen. [[Hexahydrit]] (MgSO<sub>4</sub><sub></sub> × 6H<sub>2</sub>O) ist als Reinsalz theoretisch nur im Temperaturbereich zwischen ca. 48°C und 67,5 °C stabil. [[Pentahydrit]] wird in der Literatur als an der Luft metastabil, bzw. instabil bezeichnet, trotzdem ist die Existenz dieser beiden Salzphasen an Bauwerken röntgenografisch nachgewiesen. Das Austreiben des Hydratwassers bis zum Erhalt von [[Kieserit]] kann bei erhöhten Temperaturen stattfinden. | |||
== Hydratationsdruck == | |||
Die Möglichkeit der Veränderung des Kristallwassergehaltes von Magnesiumsulfaten an Bauwerken ist erwiesen, und es ist anzunehmen, dass Wechsel im Bereich der Kristallwasserstufen [[Pentahydrit]], [[Hexahydrit]] und Epsomit (in Abhängigkeit von klimatischen Veränderungen) in situ durchlaufen werden. Der Einbau eines Wassermoleküles in das Kristallgitter des [[Hexahydrit]] und der Umbildung zu Epsomit ist mit einer Volumenzunahme von rund 10% verbunden. Der daraus resultierende Hydratationsdruck kann bei einer Temperatur von 0-20°C und einer r.F. von ca. 70% mit Werten zwischen 6,8 –9,7 N/mm<sup>2</sup> angegeben werden. Für die Umwandlung von [[Kieserit]] zu [[Hexahydrit]] ist eine Volumenzunahme von ca. 140% anzugeben [nach <bib id="Stark.etal:1996"/>]. | |||
== Umwandlungsreaktionen == | |||
= | Als Beispiel für das Schädigungspotential, das mit der Bildung von Epsomit verbunden ist, sei ein Fall dargestellt: Liegt Magnesiumcarbonat (als [[Magnesit]]) im Materialgefüge eines Denkmales vor, so kann durch die Einwirkung von Schwefelsäure Epsomit entstehen. Mit dieser Umwandlung ist eine Volumenzunahme von über 400% verbunden nach <bib id="Stark.etal:1996"/>. | ||
<br> | |||
<br> | |||
== | == Analytischer Nachweis == | ||
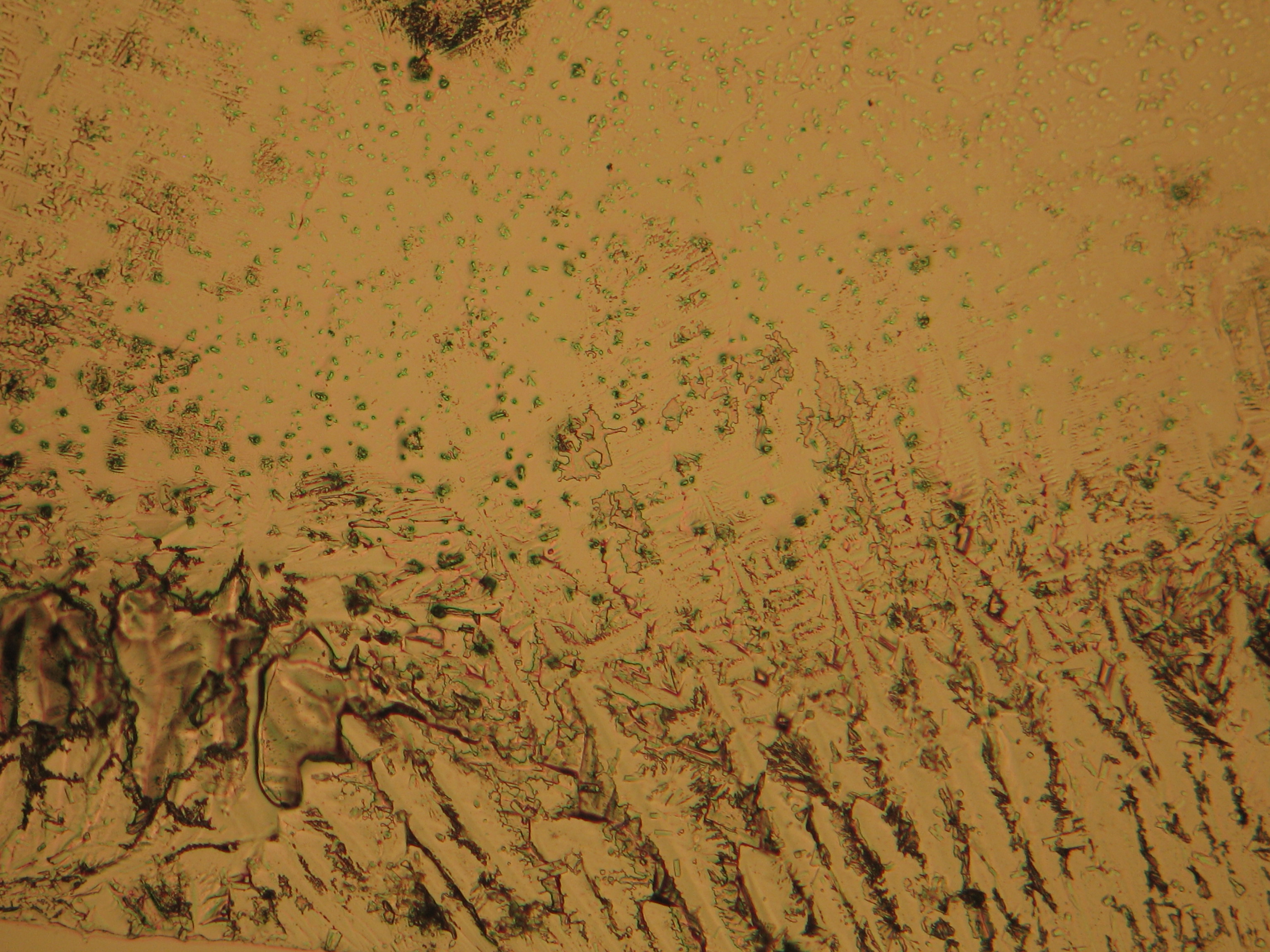
= | Kristallisiertes Magnesiumsulfat, welches an einem Objekt vorliegt, kann in unterschiedlichen Morphologien erscheinen, wobei bestimmte Erscheinungsformen vorzugsweise auftreten. Bei einem im Rahmen der Diplomarbeit von Mainusch <bib id="Mainusch:2001"/> untersuchten Objekt stellte sich die Ausbildung eines Gemisches von Epsomit und [[Hexahydrit]] in situ als lockere Kruste einer opaken, grauweißlichen Substanz dar. In Form “körniger Krusten” ist Epsomit in der Klosterkirche St. Johann in Müstair belegt, Magnesiumsulfatausblühungen in Form von Salz-Whiskern wurden in der St. Georgskirche in der Steiermark in Österreich nachgewiesen. | ||
<!-- | |||
== | === Mikrochemie === | ||
--> | |||
=== Mikroskopie === | |||
'''Laboruntersuchung:''' | |||
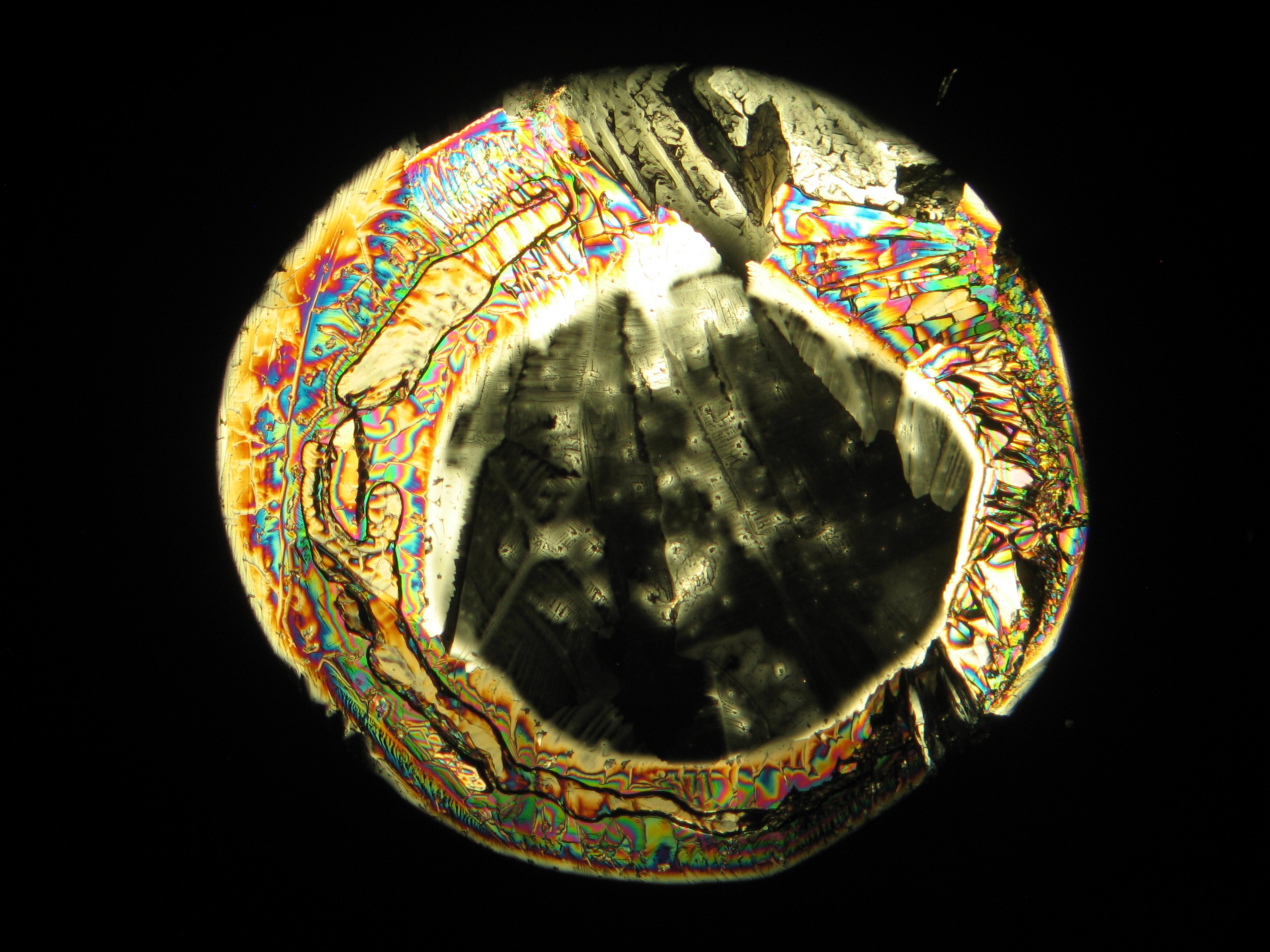
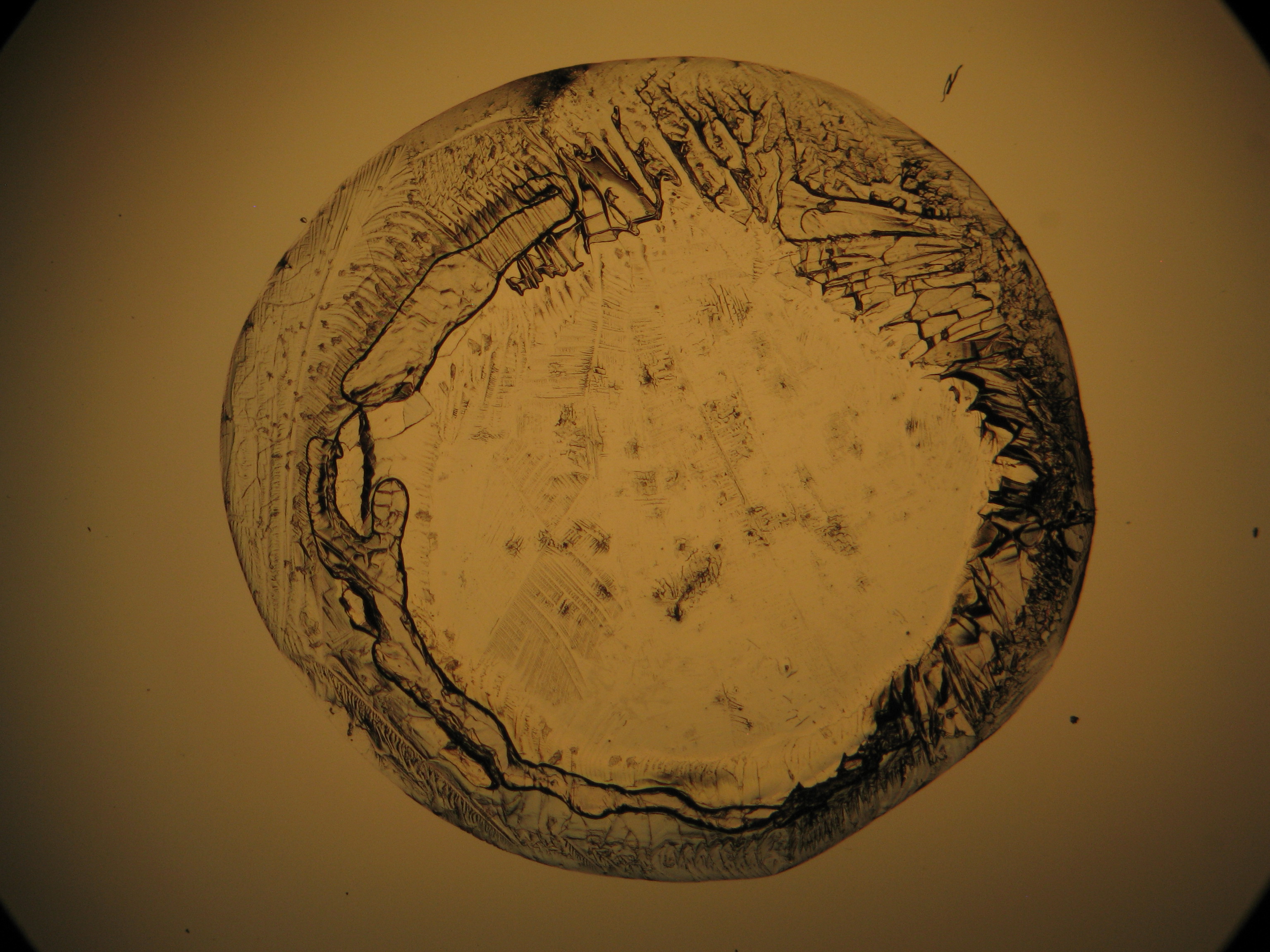
Behauchen einer überwiegend magnesiumsulfathaltigen Ausblühung bewirkt keine makroskopisch beobachtbaren Veränderungen. Charakteristisch hingegen ist das gute Lösungsverhalten in Wasser, ein pH-Wert um 7 und die Ausbildung eines mit bloßem Auge erkennbaren, ringförmigen und leicht erhabenen Saumes bzw. einer transparenten Schicht, die nach dem Verdampfen des wässrigen Lösemittels verbleibt. | |||
Im Labor sind die Ergebnisse der Objekttests unter Zuhilfenahme des Mikroskops zu überprüfen. Die Betrachtung einerseits des Rohprobematerials, wie auch des rekristallisierten Salzes zeigt: Magnesiumsulfatkristalle treten im Probematerial in sehr unspezifischen Erscheinungsformen auf. Versuche, gut ausgebildete Magnesiumsulfat-Einzelkristalle auf dem Wege der Rekristallisation aus wässriger Lösung zu erstellen, erweisen sich als sehr schwierig, da eine starke Verwachsungstendenz besteht. So bildet sich in der Regel der erwähnte auffällige, ringförmige Saum von flach ineinander verwachsenen Kristallen, wenn eine überwiegend magnesiumsulfathaltige Lösung vorsichtig eingedampft wird. Epsomit zeigt eine geringe Löslichkeit in wasserfreiem Ethanol und in Glyzerin, was unter dem Mikroskop gut zu beobachten ist. | |||
Die Tendenz von Magnesiumsulfat, beim Rekristallisieren aus wässriger Lösung kaum äquidimensionale oder elongierte Einzelkristalle auszubilden, erschwert die Erstellung guter Präparate für die weitergehende [[Polarisationsmikroskopie|polarisationsmikroskopische]] Untersuchung beträchtlich. Die geringe Ethanollöslichkeit ermöglicht es allerdings, durch sehr dosierte, eventuell mehrfache Zugabe auf das rekristallisierte Material Einzelpartikel zu isolieren. Sowohl am Ausgangsmaterial, wie auch am rekristallisierten Präparat ist die weiterfolgende Untersuchung am [[polarisationsmikroskopie|Polarisationsmikroskop]] durchzuführen.<br> | |||
<br>''' | '''Brechungsindizes''': n<sub>X</sub> = 1,433, n<sub>y</sub> = 1,455, n<sub>z</sub> <br> | ||
'''Doppelbrechung: '''Δ = max. 0,028 <br> | |||
'''Kristallklasse:''' orthorhombisch | |||
<br> | |||
<br> | |||
Die Zuweisung | '''[[Polarisationsmikroskopie|Polarisationsmikroskopische Untersuchung:]]'''<br> | ||
Die Zuweisung der Brechungsindizes von Epsomit erfolgt entsprechend der Immersionsmethode (sukzessive mittels der Einbettmedien n<sub>D</sub>=1,518; n<sub>D</sub>=1,47; n<sub>D</sub>=1,46). Bei der Verwendung eines Immersionsmediums mit Brechungsindex n<sub>D</sub>=1,45 ist bei vielen Einzelpartikeln ein geringer, jedoch klarer Wechsel im Relief bei der Rotation erkennbar. Da Epsomit zur Klasse der orthorhombischen Kristalle zählt, tritt keine schiefe, sondern stets parallele und symmetrische Auslöschung auf. Neben Epsomit bildet sich zumeist auch Hexahydrit, welches monoklin ist und nahezu identische Brechungsindizes wie Epsomit aufweist. Zwischen diesen beiden Hydratformen des Magnesiumsaulfates ist eine Unterscheidung nur über die Zuweisung der Kristallklasse möglich. Aufgrund des geringen Gangunterschiedes zeigen Epsomitkristalle in der Regel nur niedrige Interferenzfarben im Bereich der ersten Ordnung. | |||
'''Verwechslungsmöglichkeiten:'''<br> | '''Verwechslungsmöglichkeiten:'''<br> | ||
Epsomit/[[Hexahydrit]] sind zuzuweisen, sofern die unteren Untersuchungskriterien eindeutig geklärt sind: | |||
*gute Wasserlöslichkeit | |||
*charakteristisches Erscheinungsbild bei der Rekristallisation | |||
*geringe Doppelbrechung | |||
<br> | |||
<br> | |||
<!-- | |||
== | == Röntgendiffraktometrie == | ||
== | == Raman-Stektroskopie == | ||
== | == DTA / TG == | ||
== | == IR-Spektroskopie == | ||
= <br>Umgang mit Epsomitschäden = | = <br>Umgang mit Epsomitschäden = | ||
--> | |||
== | == Salze und Salzschäden im Bild == | ||
== | === Am Objekt === | ||
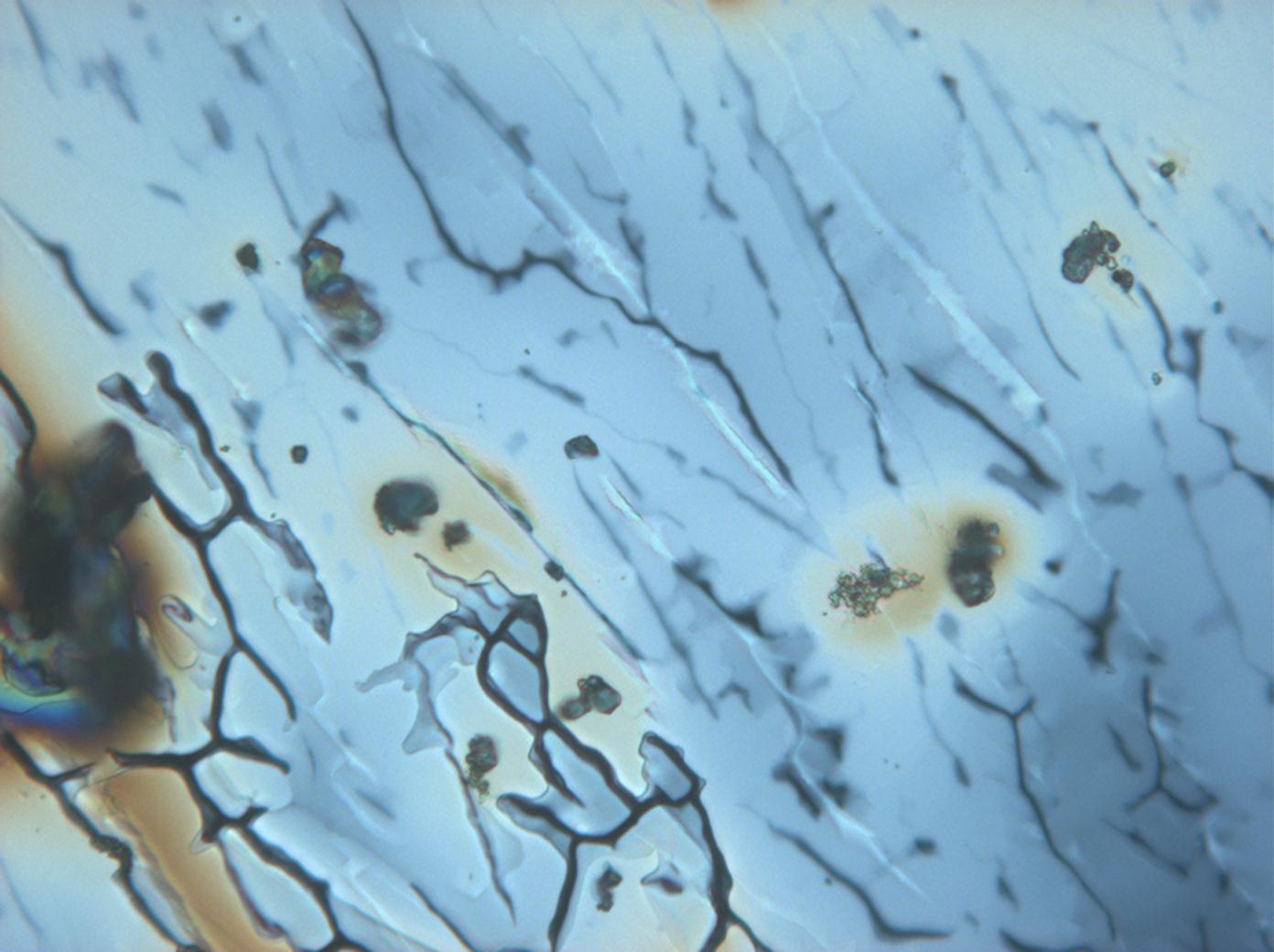
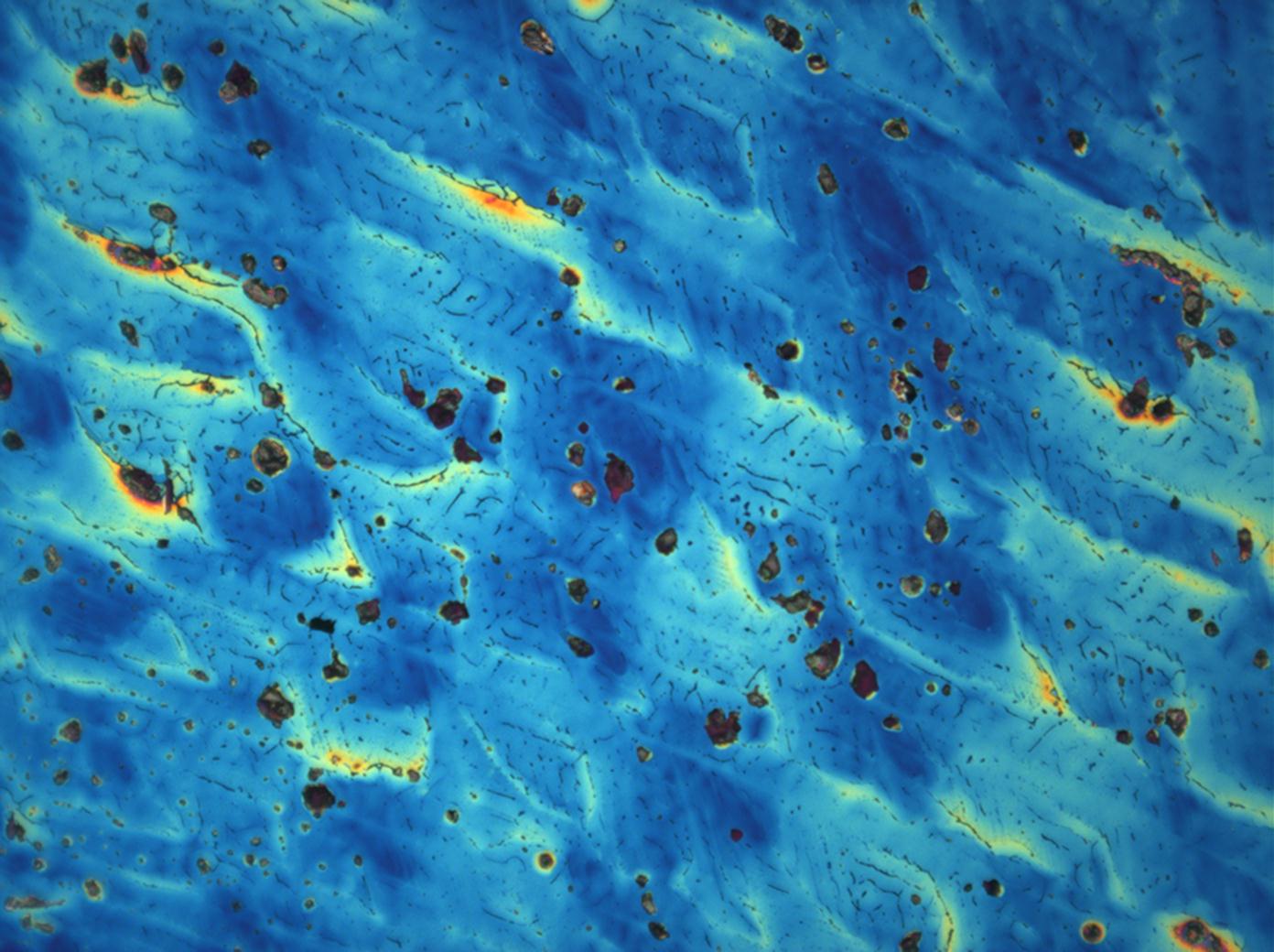
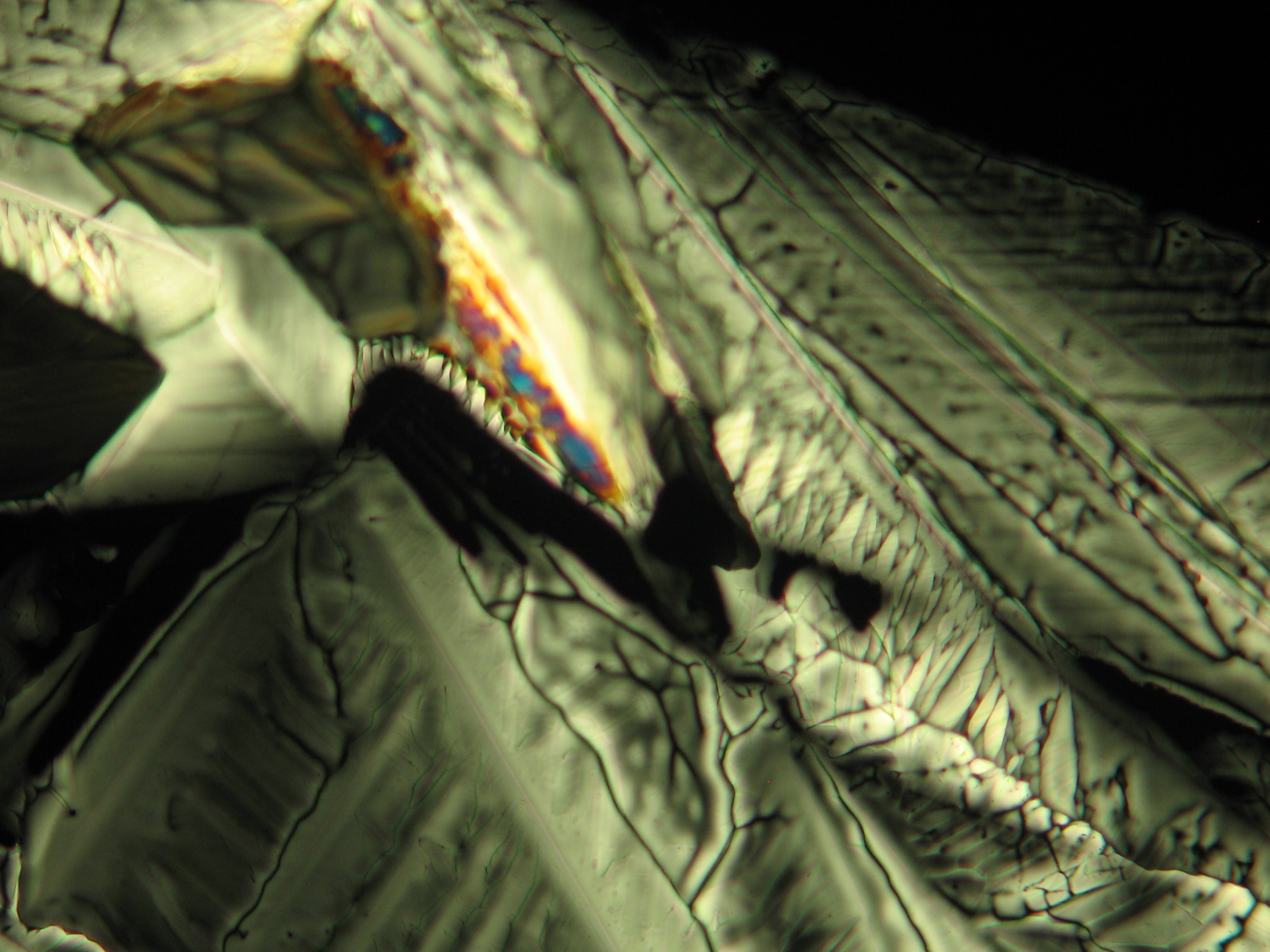
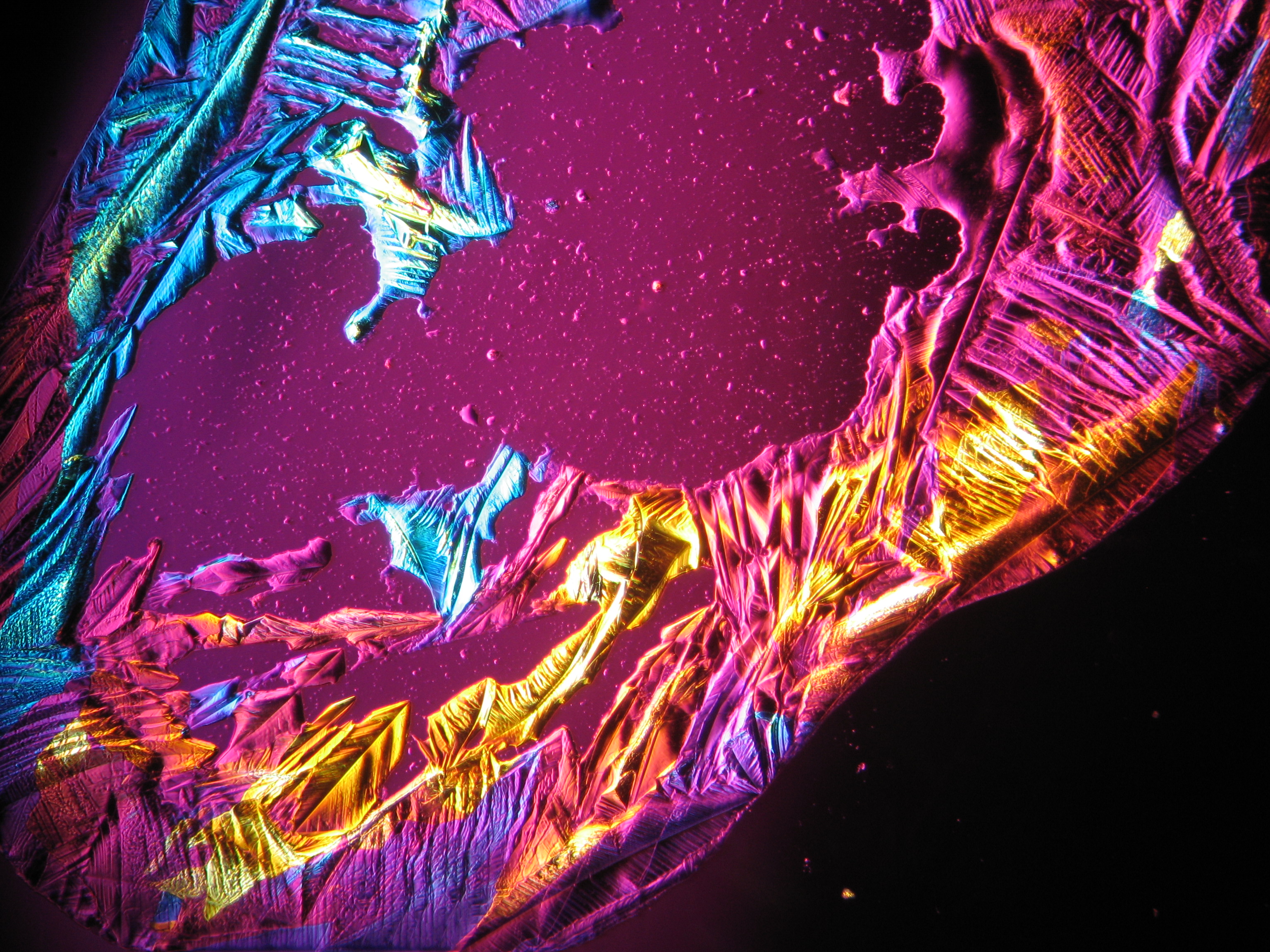
=== Unter dem Polarisationsmikroskop === | |||
= | <gallery caption="Auskristallisat aus wässrigen Proben auf Objektträger" widths="200px" heights="150px" perrow="3"> | ||
< | Image:<!--0141 0010 Bb440um 0021.JPG|Streupräparat einer Salzkruste aus Magnesiumsulfat-Whiskern--> | ||
Image:CeS 221209-02-10x-01.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-02-10x-02.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-04-2,5kx-01.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-04-2,5kx-02.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:CeS 221209-04-2,5kx-03.JPG|Reale Probe mit Magnesiumsulfatsalzen, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:HJS MgSO4 092503-1.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-2.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-3.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-5.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-8.jpg|Kieseritkristalle | |||
Image:HJS MgSO4 092503-9.jpg|Kieseritkristalle | |||
Image:MGSO4 4.5.2006 (11).JPG|Magnesiumsulfat, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MGSO4 4.5.2006 (12).JPG|Magnesiumsulfat, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MGSO4 4.5.2006 (3).JPG|Magnesiumsulfat, kristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:Magnesiumsulfat pol 01.jpg|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol 400x 01.JPG|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol+analy 400x 01.JPG|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol+analy+rotII 400x 01.JPG|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
Image:MgSO4 pol+analy.jpg|Magnesiumsulfat, auskristallisiert aus wässriger Lösung auf einem Objektträger | |||
</gallery> | |||
<!-- | |||
== Unter dem Rasterelektronenmikroskop == | |||
--> | |||
== Weblinks == | |||
<references /> | |||
< | == Literatur == | ||
<biblist/> | |||
[[Category:Epsomit]][[Category:Schwarz,Hans-Jürgen]][[Category:R-MSteiger]][[Category:Review]] [[Kategorie:Müller,Tim]][[Category:Mainusch,Nils]][[Category:Sulfat]] [[Category:Salz]][[Category:Liste]] | |||
Aktuelle Version vom 3. Mai 2023, 10:42 Uhr
Autoren: Hans-Jürgen Schwarz, Tim Müller, Nils Mainusch
zurück zu Sulfate
| Epsomit[1][2][3] | |

| |
| Mineralogische Salzbezeichnung | Epsomit |
| Chemische Bezeichnung | Magnesiumsulfat Heptahydrat |
| Trivialname | Bittersalz, Gletschersalz, Reichardit |
| Chemische Formel | MgSO4•7H2O |
| Hydratformen | Kieserit (MgSO4•H2O) Sanderit (MgSO4•2H2O) Starkeyit (MgSO4•4H2O) Pentahydrit (MgSO4•5H2O) Meridianiit (MgSO4•11H2O) Magnesium 12-Hydrat |
| Kristallsystem | orthorhombisch |
| Deliqueszenzfeuchte 20°C | 91,3 % |
| Löslichkeit(g/l) bei 20°C | 2,839 mol/kg |
| Dichte (g/cm³) | 1,68 g/cm3 |
| Molares Volumen | 146,8 cm3/mol |
| Molare Masse | 246,48 g/mol |
| Transparenz | durchsichtig bis durchscheinend |
| Spaltbarkeit | deutlich bis vollkommen |
| Kristallhabitus | kleine, nadelige oder faserige Kristalle, körnige Aggregate, Krusten |
| Zwillingsbildung | selten |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | herzustellen in wässriger Lösung unter 50°C |
| Kristalloptik | |
| Brechungsindices | nx = 1,432 ny = 1,453 nz = 1,4609 |
| Doppelbrechung | Δ = 0,0284 |
| Optische Orientierung | zweiachsig negativ |
| Pleochroismus | keiner |
| Dispersion | 51,5° |
| Verwendete Literatur | |
| [Steiger.etal:2011]Titel: Weathering and Deterioration Autor / Verfasser: Steiger, M.; Charola, A. E.; Sterflinger, K.  [Lide:1995]Titel: CRC Handbook of Chemistry and Physics [Lide:1995]Titel: CRC Handbook of Chemistry and PhysicsAutor / Verfasser: Lide D.R.  [Dana:1951]Titel: Dana's System of Mineralogy [Dana:1951]Titel: Dana's System of MineralogyAutor / Verfasser: Dana J.D. 
| |
Einleitung[Bearbeiten]
Vorkommen von Epsomit[Bearbeiten]
Als natürliches Mineral wurde Epsomit im Jahr 1695 erstmalig aus den Mineralwässern des Ortes Epsom (bei London) gewonnen, woher die mineralogische Namensgebung rührt. Ebenso wie Kieserit (Magnesiumsulfatmonohydrat) treten Einzelkristalle in der Natur selten auf. Beide Magnesiumsalze wie auch weitere Hydratstufen werden in alpinen Lagerstätten abgebaut und erscheinen zusammen mit Sylvin und Steinsalz in Norddeutschland und in den Abraumsalzen des Staßfurter Gebietes (bei Magdeburg).
Angaben zu Herkunft und Bildung von Epsomit an Baudenkmalen[Bearbeiten]
Die Bildung von Magnesiumsulfaten an Denkmalen setzt das Vorhandensein löslicher Magnesiumverbindungen, bzw. von Magnesiumionen voraus. An historischen Bauten können unterschiedliche Materialien Verwendung finden, in denen Magnesiumverbindungen enthalten sind. Einige Beispiele seien nachfolgend aufgeführt:
- Verwendung von Kalk mit dolomitischem Anteil: Dolomit ist ein Doppelsalz der Zusammensetzung CaMg(CO3)2. Wird dolomithaltiger Kalk gebrannt, gelöscht und als Mörtelmischung verwendet, liegt nach dem Prozess der Carbonatisierung sowohl CaCO3 wie auch MgCO3·xH20 vor (beispielsweise in Form von Nesquehonit, also mit drei Kristallwassermolekülen in der Form MgCO3·3H20). Die Wasserlöslichkeit von MgCO3·3H20 liegt mit ca. 1,76 g/l deutlich über den Löslichkeiten von Calcit (0,014 g/l) und Dolomit (0,078 g/l). Durch Feuchteeinwirkung gelöste Magnesiumionen können mit entsprechenden Anionen verschiedene Magnesiumsalze bilden. Die Bildung von Magnesiumsulfat kann forciert erfolgen, wenn in Verbindung mit dolomithaltigem Verputz Stuckgips oder Gipsputz am Objekt verwendet wurde und somit Sulfat im Überschuss vorliegt.
- Verwendung von Magnesiabinder: Magnesiabinder besteht im wesentlichen aus MgO und MgCl2 oder Magnesiumsulfat. Das ausreagierte und verfestigte Bindemittel kann stark hygroskopische Magnesiumsalze enthalten, welche zu Magnesiumsulfat umgebildet werden können.
- Verwendung von Zement: Nach DIN 1164 [DIN1164:1994]Titel: DIN 1164-1: Zement Teil 1, Zusammensetzung und Anforderungen
Autor / Verfasser: DIN ist in Zementen eine Höchstgehalt an MgO von 5 M.% zugelassen. Außer der Möglichkeit bei zeitverzögert verlaufendem Ablöschen durch sogenanntes „Magnesiatreiben“ Schäden zu verursachen, können theoretisch Magnesiumionen freigesetzt werden und zur Bildung von Magnesiumsulfat führen.
ist in Zementen eine Höchstgehalt an MgO von 5 M.% zugelassen. Außer der Möglichkeit bei zeitverzögert verlaufendem Ablöschen durch sogenanntes „Magnesiatreiben“ Schäden zu verursachen, können theoretisch Magnesiumionen freigesetzt werden und zur Bildung von Magnesiumsulfat führen.
Als weitere Quelle einer möglichen Magnesiumsulfatbildung ist Streusalz anzuführen, welches oft einen geringen Anteil des leichtlöslichen MgCl2 enthält. Weiterhin kann eine Magnesiumzufuhr durch stete Bodenauslaugung bei aufsteigender Feuchte erfolgen.
Lösungsverhalten[Bearbeiten]
Alle oben beschriebenen Magnesiumsulfathydratformen zählen mit einer Löslichkeit von deutlich über 100 g/l (bei 20°C) zur Gruppe der leichtlöslichen Salze. Damit ist im Prinzip eine große Mobilität des Salzes und eine häufige Verschiebung der Anreicherungszonen im Materialgefüge verbunden. Mit dem Temperatureinfluss auf die Löslichkeit kann die Gefahr eines Ausfallens gelöster Salze bei raschem Temperaturabfall verbunden sein.
Hygroskopizität[Bearbeiten]
Die geringe Hygroskopizität des Reinsalzes Epsomit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich 88-90 % r.F. deutlich wird, kann nicht isoliert betrachtet werden. In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunkt tiefer (siehe Tab.). Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben.
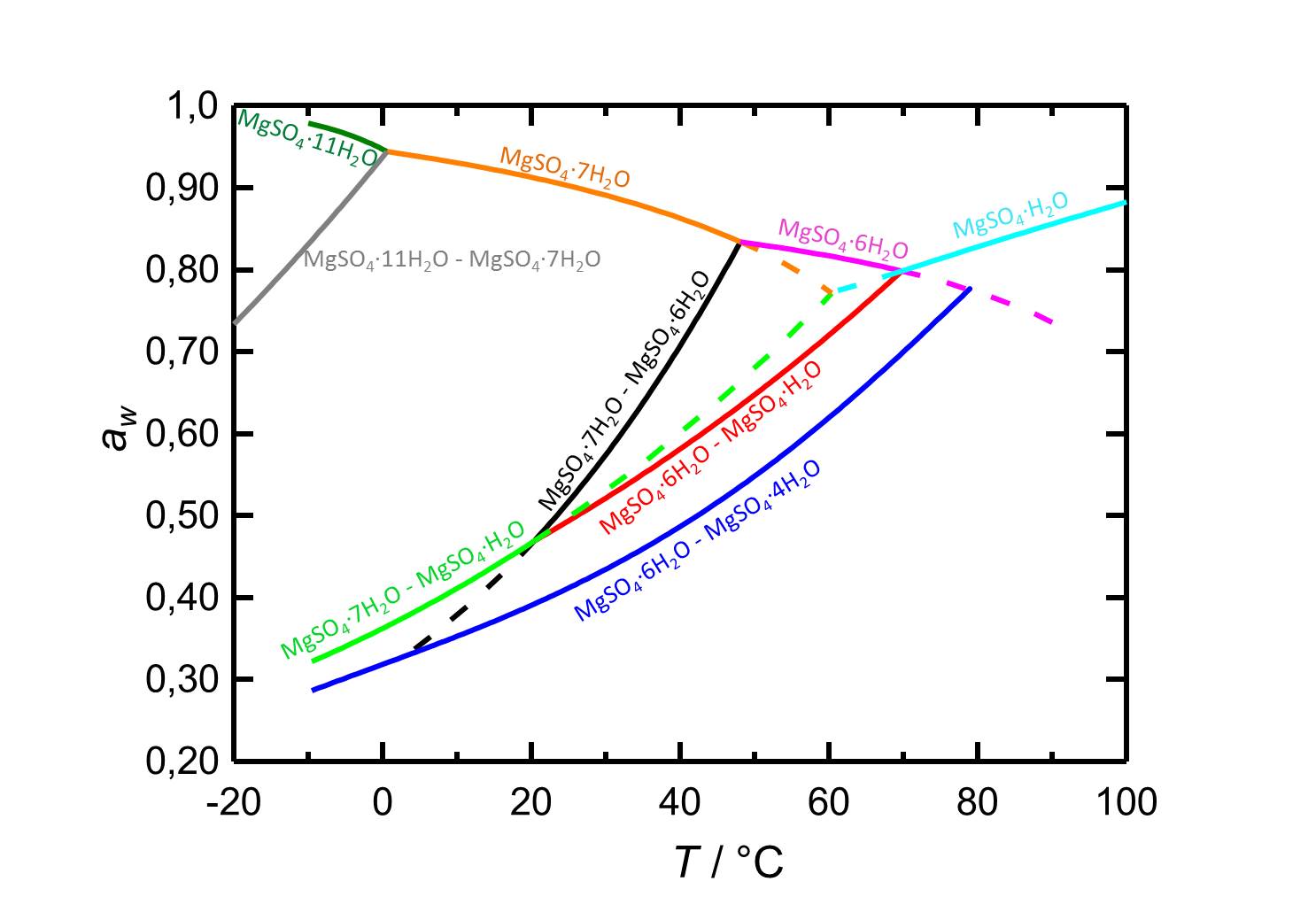
Autor / Verfasser: Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M.
 .
.
| 10°C | 20°C | 25°C | 30°C |
| 93,7% r.F. | 91,3% r.F. | 90,3% r.F. | 89,1% r.F. |
| Ca(NO3)2 | KNO3 | |
| MgSO4 xH2O | 67 (21°C) | 78(21°C) |
Feuchtesorption[Bearbeiten]
| Lagerungsfeuchte | 87%r.F. | 81%r.F. | 70%r.F. | 61%r.F. | 50%r.F. |
| MgSO4 | 76 | 75 | 70 | 71 | 27 |
| MgSO4 + NaCl (1:1 molare Mischung) |
240 | 146 | 75 | 50 | 20 |
Kristallisationsdruck[Bearbeiten]
Aufgrund der leichten Löslichkeit des Salzes treten bei entsprechenden Feuchteverhältnissen Lösungs- und Rekristallisationsvorgänge ein. Der dabei (theoretisch berechenbare) Kristallisationsdruck liegt bei Epsomit zwischen 10,5-12,5 N/mm2 und bei Hexahydrit zwischen 11,8- 14,1 N/mm2. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte somit im unteren Drittel einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm2 reicht [nach [Winkler:1975]Titel: Stone: Properties, Durability in Man ´s Environment
Autor / Verfasser: Winkler, Erhard M. ]
]
Hydratationsverhalten[Bearbeiten]
Das System MgSO4 – H2O: Als stabile Verbindungen sind die oben aufgelisteten sechs Hydratstufen des Magnesiumsulfates belegt. Mit der Ausnahme des Magnesiumsulfat-12-Hydrates wurden alle oben aufgeführten Kristallwasserstufen des Magnesiumsulfates an Baudenkmalen nachgewiesen, wobei im wesentlichen jedoch nur Epsomit, Hexahydrit, Pentahydrit und Kieserit auftreten.
Epsomit stellt bei Raumtemperatur und einer relativen Feuchte im Bereich von 50%-90% die beständigste Hydratstufe dar. Sinkt die relative Feuchte bei Raumtemperatur deutlich unter 50%, dann kommt es zu Kristallwasserabgabe und der Bildung niedrigerer Hydratstufen. Hexahydrit (MgSO4 × 6H2O) ist als Reinsalz theoretisch nur im Temperaturbereich zwischen ca. 48°C und 67,5 °C stabil. Pentahydrit wird in der Literatur als an der Luft metastabil, bzw. instabil bezeichnet, trotzdem ist die Existenz dieser beiden Salzphasen an Bauwerken röntgenografisch nachgewiesen. Das Austreiben des Hydratwassers bis zum Erhalt von Kieserit kann bei erhöhten Temperaturen stattfinden.
Hydratationsdruck[Bearbeiten]
Die Möglichkeit der Veränderung des Kristallwassergehaltes von Magnesiumsulfaten an Bauwerken ist erwiesen, und es ist anzunehmen, dass Wechsel im Bereich der Kristallwasserstufen Pentahydrit, Hexahydrit und Epsomit (in Abhängigkeit von klimatischen Veränderungen) in situ durchlaufen werden. Der Einbau eines Wassermoleküles in das Kristallgitter des Hexahydrit und der Umbildung zu Epsomit ist mit einer Volumenzunahme von rund 10% verbunden. Der daraus resultierende Hydratationsdruck kann bei einer Temperatur von 0-20°C und einer r.F. von ca. 70% mit Werten zwischen 6,8 –9,7 N/mm2 angegeben werden. Für die Umwandlung von Kieserit zu Hexahydrit ist eine Volumenzunahme von ca. 140% anzugeben [nach [Stark.etal:1996]Titel: Bauschädliche Salze
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia ].
].
Umwandlungsreaktionen[Bearbeiten]
Als Beispiel für das Schädigungspotential, das mit der Bildung von Epsomit verbunden ist, sei ein Fall dargestellt: Liegt Magnesiumcarbonat (als Magnesit) im Materialgefüge eines Denkmales vor, so kann durch die Einwirkung von Schwefelsäure Epsomit entstehen. Mit dieser Umwandlung ist eine Volumenzunahme von über 400% verbunden nach [Stark.etal:1996]Titel: Bauschädliche Salze
Autor / Verfasser: Stark, Jochen; Stürmer, Sylvia .
.
Analytischer Nachweis[Bearbeiten]
Kristallisiertes Magnesiumsulfat, welches an einem Objekt vorliegt, kann in unterschiedlichen Morphologien erscheinen, wobei bestimmte Erscheinungsformen vorzugsweise auftreten. Bei einem im Rahmen der Diplomarbeit von Mainusch [Mainusch:2001]Titel: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Autor / Verfasser: Mainusch, Nils untersuchten Objekt stellte sich die Ausbildung eines Gemisches von Epsomit und Hexahydrit in situ als lockere Kruste einer opaken, grauweißlichen Substanz dar. In Form “körniger Krusten” ist Epsomit in der Klosterkirche St. Johann in Müstair belegt, Magnesiumsulfatausblühungen in Form von Salz-Whiskern wurden in der St. Georgskirche in der Steiermark in Österreich nachgewiesen.
untersuchten Objekt stellte sich die Ausbildung eines Gemisches von Epsomit und Hexahydrit in situ als lockere Kruste einer opaken, grauweißlichen Substanz dar. In Form “körniger Krusten” ist Epsomit in der Klosterkirche St. Johann in Müstair belegt, Magnesiumsulfatausblühungen in Form von Salz-Whiskern wurden in der St. Georgskirche in der Steiermark in Österreich nachgewiesen.
Mikroskopie[Bearbeiten]
Laboruntersuchung:
Behauchen einer überwiegend magnesiumsulfathaltigen Ausblühung bewirkt keine makroskopisch beobachtbaren Veränderungen. Charakteristisch hingegen ist das gute Lösungsverhalten in Wasser, ein pH-Wert um 7 und die Ausbildung eines mit bloßem Auge erkennbaren, ringförmigen und leicht erhabenen Saumes bzw. einer transparenten Schicht, die nach dem Verdampfen des wässrigen Lösemittels verbleibt.
Im Labor sind die Ergebnisse der Objekttests unter Zuhilfenahme des Mikroskops zu überprüfen. Die Betrachtung einerseits des Rohprobematerials, wie auch des rekristallisierten Salzes zeigt: Magnesiumsulfatkristalle treten im Probematerial in sehr unspezifischen Erscheinungsformen auf. Versuche, gut ausgebildete Magnesiumsulfat-Einzelkristalle auf dem Wege der Rekristallisation aus wässriger Lösung zu erstellen, erweisen sich als sehr schwierig, da eine starke Verwachsungstendenz besteht. So bildet sich in der Regel der erwähnte auffällige, ringförmige Saum von flach ineinander verwachsenen Kristallen, wenn eine überwiegend magnesiumsulfathaltige Lösung vorsichtig eingedampft wird. Epsomit zeigt eine geringe Löslichkeit in wasserfreiem Ethanol und in Glyzerin, was unter dem Mikroskop gut zu beobachten ist.
Die Tendenz von Magnesiumsulfat, beim Rekristallisieren aus wässriger Lösung kaum äquidimensionale oder elongierte Einzelkristalle auszubilden, erschwert die Erstellung guter Präparate für die weitergehende polarisationsmikroskopische Untersuchung beträchtlich. Die geringe Ethanollöslichkeit ermöglicht es allerdings, durch sehr dosierte, eventuell mehrfache Zugabe auf das rekristallisierte Material Einzelpartikel zu isolieren. Sowohl am Ausgangsmaterial, wie auch am rekristallisierten Präparat ist die weiterfolgende Untersuchung am Polarisationsmikroskop durchzuführen.
Brechungsindizes: nX = 1,433, ny = 1,455, nz
Doppelbrechung: Δ = max. 0,028
Kristallklasse: orthorhombisch
Polarisationsmikroskopische Untersuchung:
Die Zuweisung der Brechungsindizes von Epsomit erfolgt entsprechend der Immersionsmethode (sukzessive mittels der Einbettmedien nD=1,518; nD=1,47; nD=1,46). Bei der Verwendung eines Immersionsmediums mit Brechungsindex nD=1,45 ist bei vielen Einzelpartikeln ein geringer, jedoch klarer Wechsel im Relief bei der Rotation erkennbar. Da Epsomit zur Klasse der orthorhombischen Kristalle zählt, tritt keine schiefe, sondern stets parallele und symmetrische Auslöschung auf. Neben Epsomit bildet sich zumeist auch Hexahydrit, welches monoklin ist und nahezu identische Brechungsindizes wie Epsomit aufweist. Zwischen diesen beiden Hydratformen des Magnesiumsaulfates ist eine Unterscheidung nur über die Zuweisung der Kristallklasse möglich. Aufgrund des geringen Gangunterschiedes zeigen Epsomitkristalle in der Regel nur niedrige Interferenzfarben im Bereich der ersten Ordnung.
Verwechslungsmöglichkeiten:
Epsomit/Hexahydrit sind zuzuweisen, sofern die unteren Untersuchungskriterien eindeutig geklärt sind:
- gute Wasserlöslichkeit
- charakteristisches Erscheinungsbild bei der Rekristallisation
- geringe Doppelbrechung
Salze und Salzschäden im Bild[Bearbeiten]
Am Objekt[Bearbeiten]
Unter dem Polarisationsmikroskop[Bearbeiten]
- Auskristallisat aus wässrigen Proben auf Objektträger
Weblinks[Bearbeiten]
- ↑ http://webmineral.com/data/Epsomite.shtml gesehen 29.072010
- ↑ http://www.mindat.org/min-1393.html gesehen 29.072010
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Epsomit gesehen 29.072010
Literatur[Bearbeiten]
| [DIN1164:1994] | DIN (1994): DIN 1164-1: Zement Teil 1, Zusammensetzung und Anforderungen. |  |
| [Dana:1951] | Dana E.S. (Hrsg.) Dana J.D. (1951): Dana's System of Mineralogy, 7, Wiley & Sons |  |
| [Lide:1995] | Lide D.R. (Hrsg.) Lide D.R. (1995): CRC Handbook of Chemistry and Physics, CRC Press |  |
| [Mainusch:2001] | Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
| [Stark.etal:1996] | Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
| [Steiger.etal:2011] | Steiger, M.; Charola, A. E.; Sterflinger, K. (2011): Weathering and Deterioration. In: Siegesmund, Siegfried; Snethlage, Rolf (Hrsg.): Stone in Architecture - Properties, Durability, Springer, 225-316, https://doi.org/10.1007/978-3-642-45155-3_4. |  |
| [Steiger.etal:2011a] | Steiger, M.; Linnow, K.; Ehrhardt, D.; Rohde, M. (2011): Decomposition reactions of magnesium sulfate hydrates and phase equilibria in the MgSO4-H2O and Na+-Mg2+-Cl--SO42--H2O systems with implications for Mars. In: Geochimica et Cosmochimica Act, 75 (12), 3600-3626, https://doi.org/10.1016/j.gca.2011.03.038 |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |
| [Winkler:1975] | Winkler, Erhard M. (1975): Stone: Properties, Durability in Man ´s Environment, Springer Verlag, Wien |  |