Natriumsulfat Phase III: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: „Autoren: Amelie Stahlbuhk <br>zurück zu Sulfate {{Infobox_Salz |Footnote= |bild = |mineralogischerName= |chemischerName =Natriumsu…“) |
|||
| (3 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Autoren: [[Benutzer:AStahlbuhk|Amelie Stahlbuhk ]] | Autoren: [[Benutzer:AStahlbuhk|Amelie Stahlbuhk ]] | ||
<br>zurück zu [[Sulfate]] | <br>zurück zu [[Sulfate]] | ||
{{Baustelle}} | |||
{{Infobox_Salz | {{Infobox_Salz | ||
| Zeile 42: | Zeile 44: | ||
==Löslichkeit== | ==Löslichkeit== | ||
[[Datei:L Na2SO4.jpg|thumb|800px|left|'''Abbildung 1''': Löslichkeiten im System Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O in Abhängigkeit der Temperatur, nach <bib id="Steiger.etal:2008"/>.]] | |||
[[Datei:L Na2SO4.jpg|thumb|800px| | |||
<br clear=all> | <br clear=all> | ||
| Zeile 51: | Zeile 52: | ||
==Hygroskopizität== | ==Hygroskopizität== | ||
[[Datei:D Na2SO4 d.jpg|thumb|800px|left|'''Abbildung 2''':Deliqueszenzfeuchten im System Na<sub>2</sub>SO<sub>4</sub>-H<sub>2</sub>O, sowie Gleichgewichtsfeuchten der Thenardit-Mirabilit-Umwandlung. Nach <bib id="Steiger.etal:2008"/>]] | |||
[[Datei:D Na2SO4 d.jpg|thumb|800px| | |||
<br clear=all> | <br clear=all> | ||
| Zeile 84: | Zeile 84: | ||
<biblist/> | <biblist/> | ||
[[Category:Natriumsulfat]][[Category:Natriumsulfat Phase III]][[Category: | [[Category:Natriumsulfat]][[Category:Natriumsulfat Phase III]][[Category:Stahlbuhk,Amelie]][[Category:R-MSteiger]][[Kategorie:InProgress]][[Category:Sulfat]] [[Category:Salz]][[Category:Liste]] | ||
Aktuelle Version vom 3. Mai 2023, 11:22 Uhr
Autoren: Amelie Stahlbuhk
zurück zu Sulfate
| Dieser Artikel wird gerade neu erstellt und ist noch nicht vollständig. |
| Natriumsulfat Phase III | |
| Mineralogische Salzbezeichnung | |
| Chemische Bezeichnung | Natriumsulfat Phase III |
| Trivialname | |
| Chemische Formel | Na2SO4 |
| Hydratformen | Na2SO4•7H2O (Natriumsulfat-Heptahydrat) Na2SO4•10H2O (Mirabilit) |
| Kristallsystem | |
| Deliqueszenzfeuchte 20°C | 82,9 % |
| Löslichkeit(g/l) bei 20°C | 4,428 mol/kg |
| Dichte (g/cm³) | |
| Molares Volumen | |
| Molare Masse | 142,04 g/mol |
| Transparenz | |
| Spaltbarkeit | |
| Kristallhabitus | |
| Zwillingsbildung | |
| Phasenübergang | |
| Chemisches Verhalten | |
| Bemerkungen | |
| Kristalloptik | |
| Brechungsindices | |
| Doppelbrechung | |
| Optische Orientierung | |
| Pleochroismus | |
| Dispersion | |
| Verwendete Literatur | |
| [Steiger.etal:2008]Titel: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress Autor / Verfasser: Steiger, Michael; Asmussen, Sönke 
| |
Abstract[Bearbeiten]
Natriumsulfat Phase III als metastabile, wasserfreie Phase des Natriumsulfats und seine Eigenschaften werden vorgestellt.
Vorkommen[Bearbeiten]
Beobachtet wurde diese Phase neben Thenardit bei der Verdunstung von Natriumsulfat-Lösungen oberhalb von 32,4 °C, also oberhalb der Umwandlungstemperatur von Mirabilit zu Thenardit, wobei die Menge an Phase III bei steigender Temperatur zunimmt [Amirthalingam.etal:1977]Titel: Topotaxic phase change in Na2SO4
Autor / Verfasser: Amirthalingam V., Karkhanavala M. D., Rao U. R. K. , [Grossi.etal:1997]Titel: Acoustic emmission monitoring to study sodium sulphate crystallization in monumental porous carbonate stones
, [Grossi.etal:1997]Titel: Acoustic emmission monitoring to study sodium sulphate crystallization in monumental porous carbonate stones
Autor / Verfasser: Grossi, C.M.; Esbert, R.M.; Suárez del Rio, L.M.; Montoto, M.; Laurenzi-Tabasso, M. .
Außerdem wurde Natriumsulfat Phase III bei Verdunstungsexperimenten mit Natriumsulfat-Lösungen bei Raumtemperatur und geringer relativer Luftfeuchte beobachtet [Linnow.etal:2006]Titel: Investigation of Sodium Sulfate Phase Transitions in a Porous Material Using Humidity- and Temperature-Controlled X-ray Diffraction
.
Außerdem wurde Natriumsulfat Phase III bei Verdunstungsexperimenten mit Natriumsulfat-Lösungen bei Raumtemperatur und geringer relativer Luftfeuchte beobachtet [Linnow.etal:2006]Titel: Investigation of Sodium Sulfate Phase Transitions in a Porous Material Using Humidity- and Temperature-Controlled X-ray Diffraction
Autor / Verfasser: Linnow, Kirsten; Zeunert, Anke; Steiger, Michael , [Xu.etal:1999]Titel: In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.
, [Xu.etal:1999]Titel: In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.
Autor / Verfasser: Xu B., Schweiger G. , [Rodriguez-Navarro.etal:1999]Der Eintrag existiert noch nicht..
, [Rodriguez-Navarro.etal:1999]Der Eintrag existiert noch nicht..
Löslichkeit[Bearbeiten]
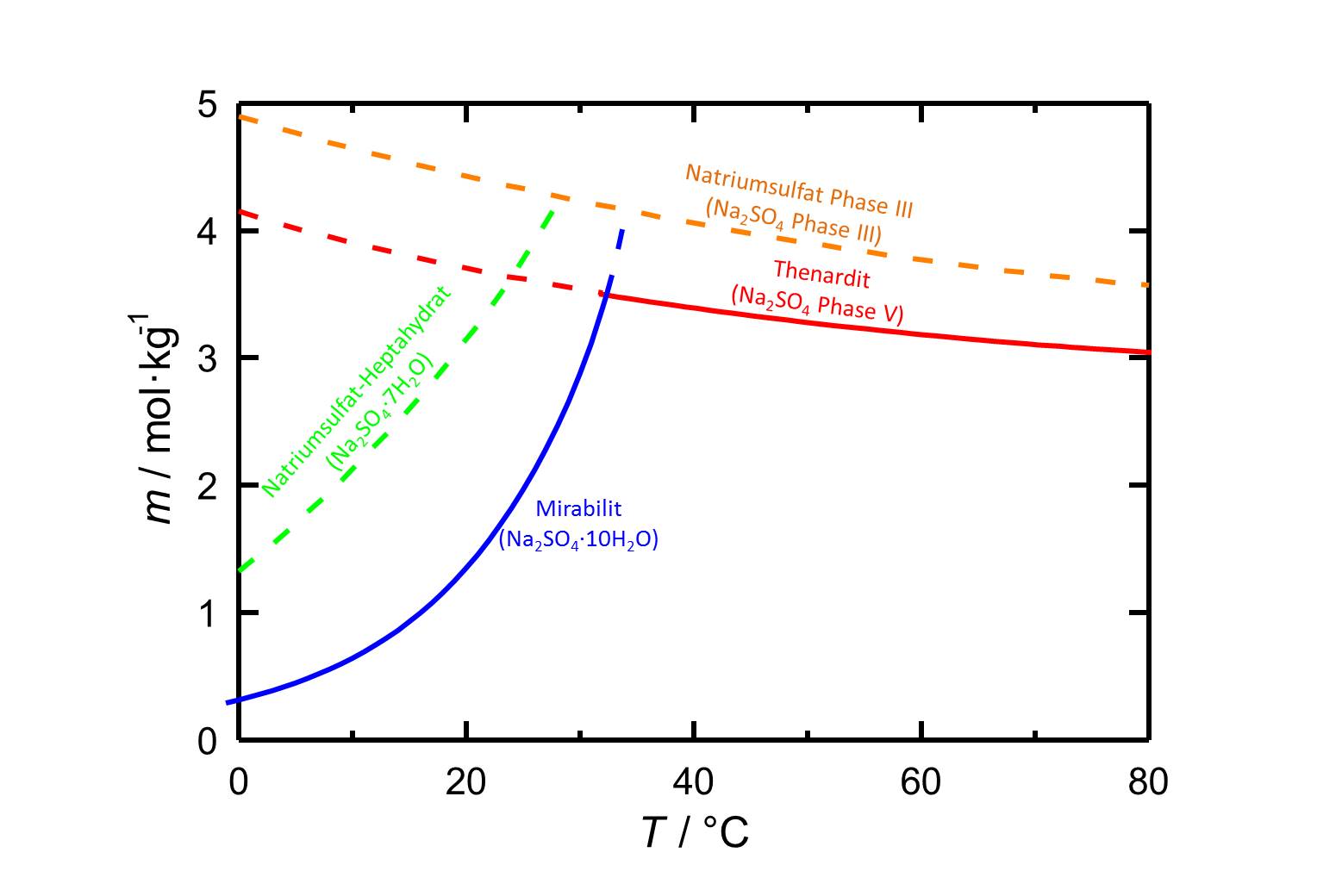
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke
 .
.
Mit einer Löslichkeit von 4,4 mol/kg bei 20 °C [Steiger.etal:2008]Titel: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke weist Natriumsulfat Phase III eine höhere Löslichkeit auf als die anderen Natriumsufat-Phasen.
Siehe auch Natriumsulfat
weist Natriumsulfat Phase III eine höhere Löslichkeit auf als die anderen Natriumsufat-Phasen.
Siehe auch Natriumsulfat
Hygroskopizität[Bearbeiten]
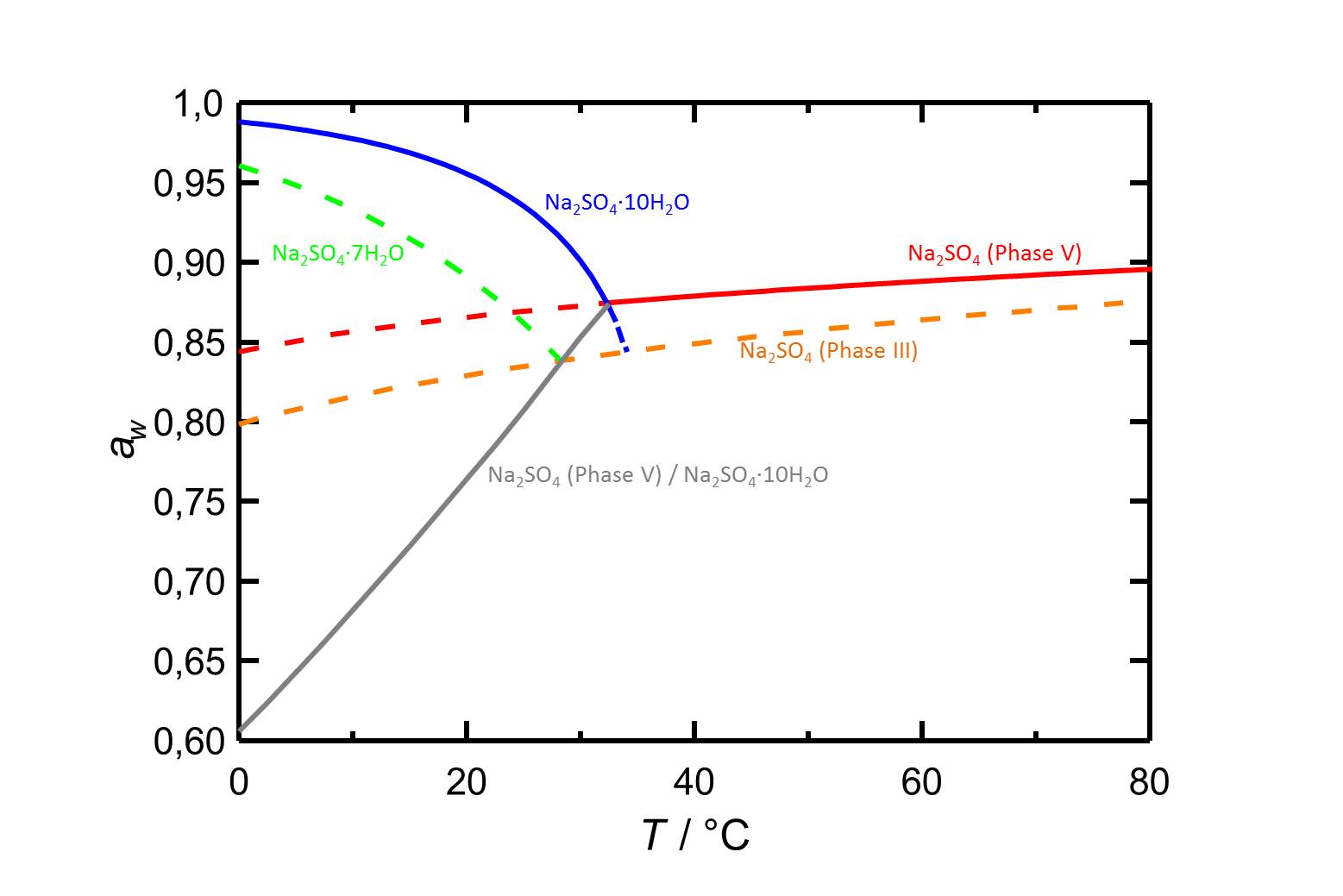
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke

Die Deliqueszenzfeuchte des metastabilen Natriumsulfats Phase III beträgt bei 20 °C 82,9 % [Steiger.etal:2008]Titel: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress
Autor / Verfasser: Steiger, Michael; Asmussen, Sönke und nimmt bei steigender Temperatur langsam zu.
und nimmt bei steigender Temperatur langsam zu.
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C |
| 79,9%r.F. | 81,6%r.F. | 82,9%r.F. | 84,0%r.F. | 84,9%r.F. | 85,7%r.F. |
Weblinks
[Bearbeiten]
Literatur[Bearbeiten]
| [Amirthalingam.etal:1977] | Amirthalingam V., Karkhanavala M. D., Rao U. R. K. (1977): Topotaxic phase change in Na2SO4. In: Acta Crystallographica Section A, 33 (3), 522-523, https://doi.org/10.1107/S0567739477001296 |  |
| [Grossi.etal:1997] | Grossi, C.M.; Esbert, R.M.; Suárez del Rio, L.M.; Montoto, M.; Laurenzi-Tabasso, M. (1997): Acoustic emmission monitoring to study sodium sulphate crystallization in monumental porous carbonate stones. In: Studies in Conservation, (2), 115-125 |  |
| [Linnow.etal:2006] | Linnow, Kirsten; Zeunert, Anke; Steiger, Michael (2006): Investigation of Sodium Sulfate Phase Transitions in a Porous Material Using Humidity- and Temperature-Controlled X-ray Diffraction. In: Analytical Chemistry, 78 (13), 4683-4689, Webadresse, https://doi.org/10.1021/ac0603936 |  |
| [Rodriguez-Navarro.etal:1999] | Der Eintrag existiert noch nicht. | |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4 -H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Webadresse, https://doi.org/10.1016/j.gca.2008.05.053 |  |
| [Xu.etal:1999] | Xu B., Schweiger G. (1999): In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.. In: J. Aerosol. Sci., (), 379-380, Webadresse, https://doi.org/10.1016/S0021-8502(99)80201-8 |  |