Salzgemische: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 9: | Zeile 9: | ||
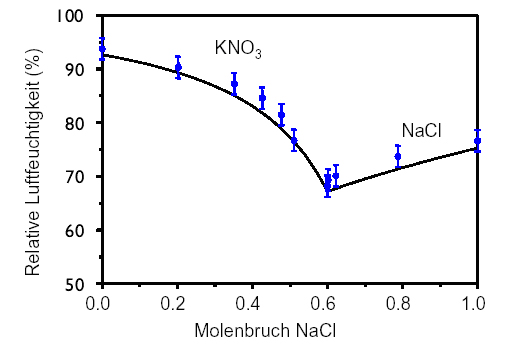
[[Image:NaCl-RH.jpg|thumb|right|300px|Abbildung 1: Die relative Luftfeuchte in Abhängigkeit vom Molenbruch im System K-Na- Cl - NO3 (nach <bib id=Steiger:2002/>]] | [[Image:NaCl-RH.jpg|thumb|right|300px|Abbildung 1: Die relative Luftfeuchte in Abhängigkeit vom Molenbruch im System K-Na- Cl - NO3 (nach <bib id=Steiger:2002/>]] | ||
Selten tritt an einem Objekt nur ein einziges Salz auf. Die Analysen von Materialproben zeigen meist Mischungen aus mehreren Ionen wie z. B. des Magnesium, Kalium, Natrium und Chlorid, Sulfat und Nitrat. Wie reagieren nun diese Salzgemische auf ein vorhandenes Klima bzw. welche relativ Luftfeuchte stellt sich über einer Salzmischung ein. Nur in unendlich verdünnten Lösung reagieren Salze vollkommen unabhängig voneinander und nur dann könnte man sie getrennt wie die einzelnen Salze behandeln. Eine Kristallisation findet jedoch aus einer gesättigten Lösung statt, in der die einzelnen Ionen meist sehr stark miteinander in Wechselwirkung treten. Diese nicht idealen, komplexen, Systeme müssen somit getrennt behandelt werden. ZU zeihgt eien einfache Mischung von KNO<sub>3 | Selten tritt an einem Objekt nur ein einziges Salz auf. Die Analysen von Materialproben zeigen meist Mischungen aus mehreren Ionen wie z. B. des Magnesium, Kalium, Natrium und Chlorid, Sulfat und Nitrat. Wie reagieren nun diese Salzgemische auf ein vorhandenes Klima bzw. welche relativ Luftfeuchte stellt sich über einer Salzmischung ein. Nur in unendlich verdünnten Lösung reagieren Salze vollkommen unabhängig voneinander und nur dann könnte man sie getrennt wie die einzelnen Salze behandeln. Eine Kristallisation findet jedoch aus einer gesättigten Lösung statt, in der die einzelnen Ionen meist sehr stark miteinander in Wechselwirkung treten. Diese nicht idealen, komplexen, Systeme müssen somit getrennt behandelt werden. ZU zeihgt eien einfache Mischung von KNO<sub>3</sub> und NaCl deutlich andere Deliqueszenzfeuchten als die reinen Salze (Abb. 1) | ||
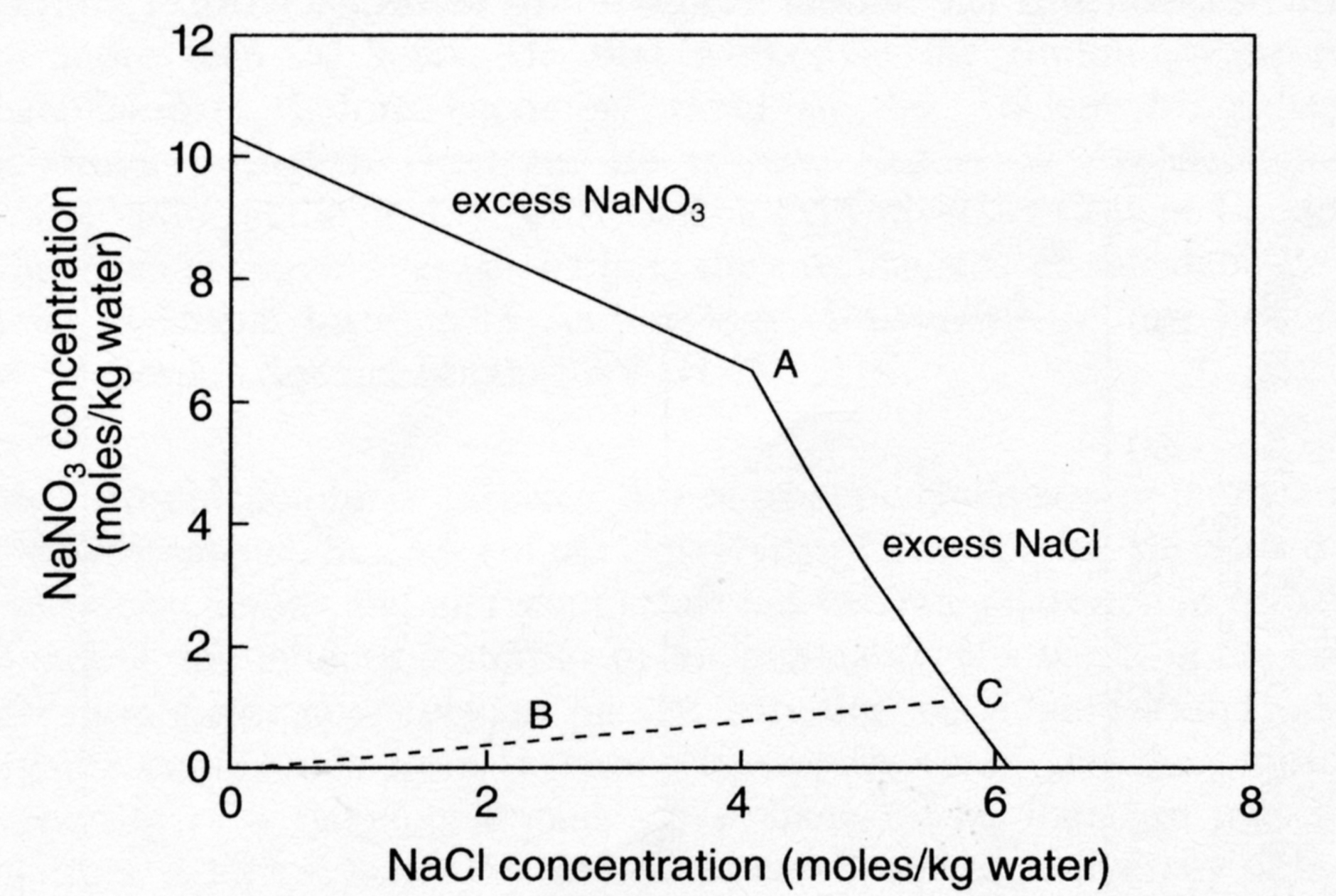
[[Image:NaNO3-NaCl Phasen.jpg|thumb|right|300px|Abbildung 2: Kristallisationspfade im System NaNO3-NaCl-H2O (nach <bib id=Price.etal:1994/>]] | [[Image:NaNO3-NaCl Phasen.jpg|thumb|right|300px|Abbildung 2: Kristallisationspfade im System NaNO3-NaCl-H2O (nach <bib id=Price.etal:1994/>]] | ||
Version vom 23. Juli 2010, 10:48 Uhr
__NORICHEDITOR__
<bibimport/>
Autoren: Michael Steiger, Hans-Jürgen Schwarz
zurück zu Salze/Salzgemische
Einführung[Bearbeiten]
Autor / Verfasser: Steiger, Michael

Selten tritt an einem Objekt nur ein einziges Salz auf. Die Analysen von Materialproben zeigen meist Mischungen aus mehreren Ionen wie z. B. des Magnesium, Kalium, Natrium und Chlorid, Sulfat und Nitrat. Wie reagieren nun diese Salzgemische auf ein vorhandenes Klima bzw. welche relativ Luftfeuchte stellt sich über einer Salzmischung ein. Nur in unendlich verdünnten Lösung reagieren Salze vollkommen unabhängig voneinander und nur dann könnte man sie getrennt wie die einzelnen Salze behandeln. Eine Kristallisation findet jedoch aus einer gesättigten Lösung statt, in der die einzelnen Ionen meist sehr stark miteinander in Wechselwirkung treten. Diese nicht idealen, komplexen, Systeme müssen somit getrennt behandelt werden. ZU zeihgt eien einfache Mischung von KNO3 und NaCl deutlich andere Deliqueszenzfeuchten als die reinen Salze (Abb. 1)
Autor / Verfasser: Price, Clifford A.; Brimblecomb, Peter

Betrachtet man z. B. eine einfache Mischung aus drei Salzionen, aus Natriumnitrat und Natriumchlorid (siehe Abb. 2). Die Abbildung zeigt die Löslichkeit von Natriumchlorid in einer Natriumnitratlösung und umgekehrt. Punkt A stellt den einzigen Punkt dar, an dem beide Salze und Wasser im Gleichgewicht auftreten. Betrachten wir eine verdünnte Lösung von Natriumchlorid und Natriumnitrat im Verhältnis 5:1, repräsentiert durch die Gerade mit dem Punkt B. Verdunstet das Lösungsmittel, so folgt die Zusammensetzung der Salzlösung der Geraden durch BC bis der Punkt C erreicht ist. Am Punkt C kristallisiert dann Natriumchlorid aus. Verdunstet weiter Wasser so steigt die Konzentration des Nitrats im Verhältnis zum Chlorid und die Zusammensetzung der Lösung folgt bei weiterer Kristallisation von Natriumchlorid der Geraden CA. Beim Punkt A kristallisieren dann beide Salze zusammen aus. Wie verhalten sich aber die dazugehörigen Luftfeuchten über den Lösungen. Wie sieht die RH an dem Punkt aus, an dem die ersten Natriumchloridkristalle auftreten. Price und Brimblecombe [Price.etal:1994]Titel: Preventing salt damage in porous materials
Autor / Verfasser: Price, Clifford A.; Brimblecomb, Peter haben dazu Berechnungen mit einem Programm von Clegg, der den Berechnungsformalismus von Pitzer [Pitzer:1991]Titel: Activity coefficients in electrolyte solutions
haben dazu Berechnungen mit einem Programm von Clegg, der den Berechnungsformalismus von Pitzer [Pitzer:1991]Titel: Activity coefficients in electrolyte solutions beinhaltet, durchgeführt.
beinhaltet, durchgeführt.
Dieser Formalismus berücksichtigt die Wechselwirkungen zwischen den verschiedenen Ionen. Mit ihm kann eine Reihe von Eigenschaften, einschließlich der relativen Luftfeuchte im Gleichgewicht mit einer Salzmischung einer definierten Zusammensetzung berechnet werden.
Für obige Salzmischungen ergeben die Berechnungen einen Wert von 73.9% RH am Punkt C und für den Punkt A 67.9% RH. (beide Salze haben in etwa eine Gleichgewichtsfeuchte von 75% RH).
Die Gleichgewichtsfeuchte von Salzmischungen der beiden betrachteten Salze liegen also immer unter den Gleichgewichtsfeuchten der einzelnen Salze, obwohl im betrachteten Fall beide Salze die gleiche Gleichgewichtsfeuchten aufweisen. Es ist somit klar, dass die Wechselwirkungen selbst bei einfachen Salzmischungen die relativen Luftfeuchten und damit auch die Kristallisatonsbereiche der Salze radikal verändern.
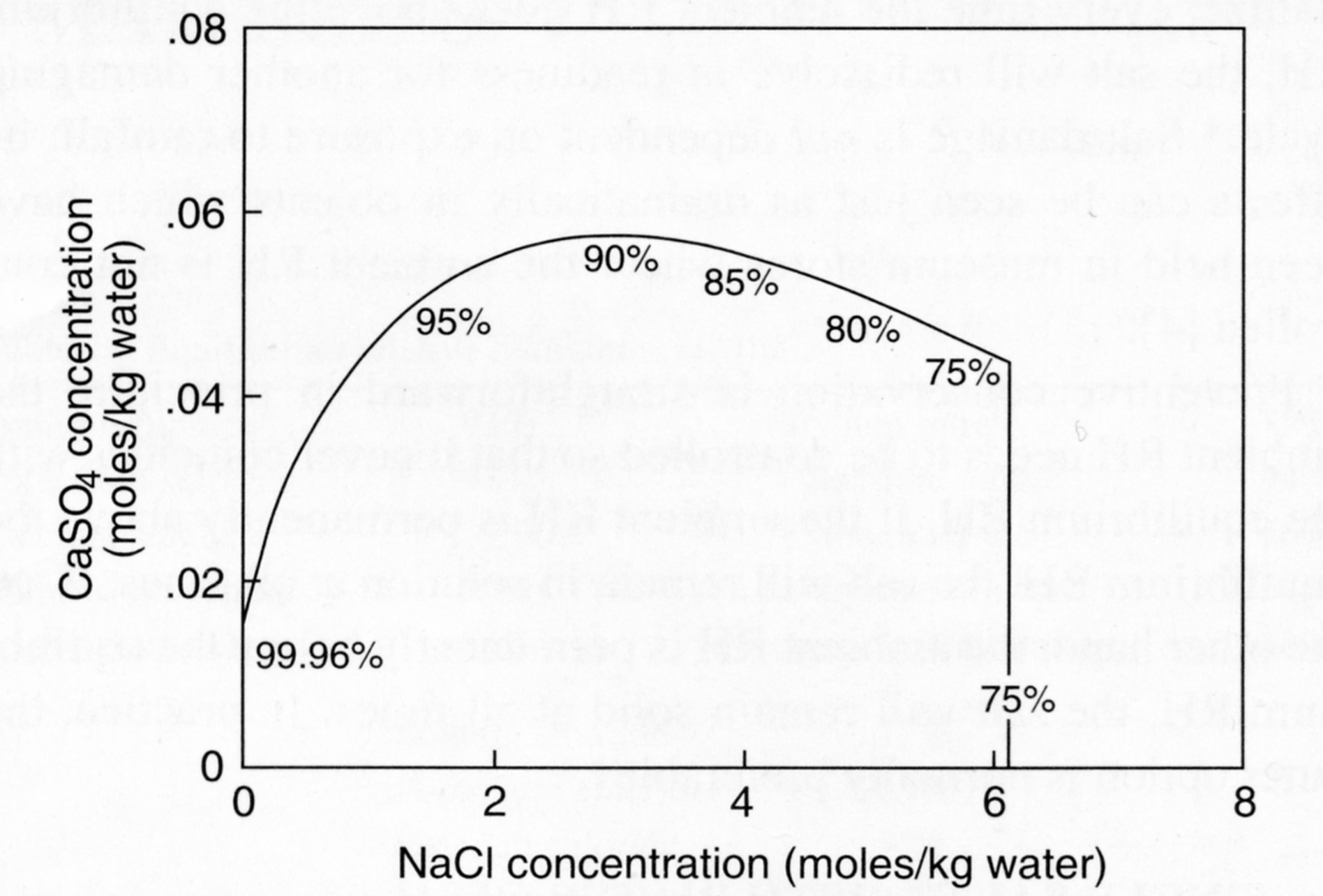
Autor / Verfasser: Price, Clifford A.; Brimblecomb, Peter

Ein anderer Fall stellt die Abbildung 3 dar. Im System Natriumchlorid/Calciumsulfat, das in zahlreichen Objekten nahe am Meer anzutreffen ist, liegt die Ursache für einen schnelleren Schadensfortschritt, verglichen mit den Einzelsalzen verborgen. Während geringe Mengen an Calciumsulfat die Löslichkeit von Natriumchlorid kaum beeinflussen, hat Natriumchlorid einen großen Einfluss auf die Löslichkeit von Gips. Mit zunehmender Konzentration von Natriumchlorid nimmt die Löslichkeit von Calciumsulfat zunächst stark zu, um bei weiterer Zunahme an Natriumchlorid bis zur gesättigten Lösung wieder leicht abzunehmen.
Der hohe Gehalt an Natriumchlorid erhöht somit nicht nur die Löslichkeit von Calciumsulfat, sondern bewirkt auch die Kristallisation von Gips sowohl bei Abnahme der RH von 90 auf 75 %RH als auch bei Zunahme auf über 90% RH. Während reines Calciumsulfat nur bei Einfluss von flüssigem Wasser direkt einen Schaden bewirken kann, kann es bei Anwesenheit von Natriumchlorid auch durch Änderungen der Luftfeuchte, die im Bereich üblicher Werte für Innenraumklimata liegt, zu Schäden kommen.
In Tabelle 1 sind die relativen Luftfeuchte über gesättigten /konzentrierten Lösungen von Salzen dargestellt.
| RF [%] | NaCl | Ca Cl2 | Na2 SO4 | Mg SO4 | Ca(NO3)2 | KNO3 |
| NaCl | 74 | 31 | 71 | 69 | 61 | 67 |
| CaCl2 | 22?? | |||||
| Na2SO4 | 94 | 87 | 74 | 81 | ||
| Mg SO4 | 82 | 67 | 78 | |||
| Ca(NO3)2 | 54 | 51 | ||||
| KNO3 | 92 |
Literatur[Bearbeiten]
[Filter fehlt] __NORICHEDITOR__